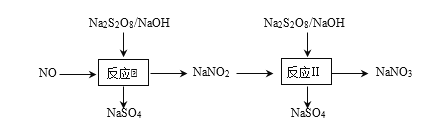
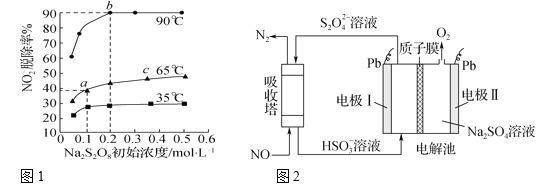
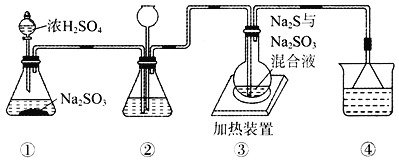
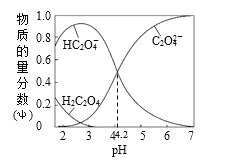
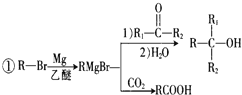
【题目】500℃时,在四个体积为2L的恒容密闭容器中发生反应:NO2(g) + SO2(g)![]() SO3(g)+ NO(g)。有关物质起始时的物质的量数据如下表所示:
SO3(g)+ NO(g)。有关物质起始时的物质的量数据如下表所示:
容器 | 起始时物质的量/mol | |||
NO2 | SO2 | SO3 | NO | |
甲 | 0.1 | 0.1 | 0 | 0 |
乙 | 0.15 | 0.05 | 0.05 | 0.05 |
丙 | 0 | 0 | 0.2 | 0.2 |
丁 | 0.1 | 0.2 | 0 | 0 |
已知甲容器达到平衡时容器中c(SO3)=0.01mol·L-1。下列说法正确的是
A.升温至700℃,上述反应的平衡常数为![]() ,则正反应为吸热反应
,则正反应为吸热反应
B.达平衡时,容器丙中c(SO2)是容器甲的2倍
C.达平衡时,容器丁中c(NO)与乙容器中相同
D.保持温度不变容器甲达到平衡时再充入SO2(g)和SO3(g)各0.02mol,此时v(正)>v(逆)
【题目】室温下进行下列实验,根据实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 用Zn和稀硫酸反应制取氢气,向反应液中滴入几滴CuSO4溶液,产生气泡的速率明显加快 | Cu2+是反应的催化剂 |
B | 向滴有酚酞的1mL0.1mol·L-1Na2CO3溶液中加水稀释至10mL,红色变浅 | 加水稀释时,CO32—的水解平衡向逆反应方向移动 |
C | 向5 mL 0.1 mol·L-1 KI溶液中加入0.1 mol·L-1 FeCl3溶液1 mL,振荡,用苯萃取2~3次后,取下层溶液滴加5滴KSCN溶液,出现血红色 | 反应2Fe3++2I-=2Fe2++I2是有一定限度的 |
D | 向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸有气泡产生 | Ksp(BaCO3)<Ksp(BaSO4) |
A.AB.BC.CD.D