题目内容
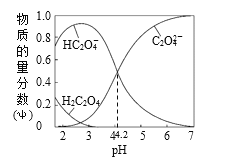
【题目】常温下将0.100mol·L—1的NaOH溶液滴加到20mL 0.100mol·L—1的草酸(分子式为H2C2O4,二元弱酸)溶液中,滴加过程中,溶液中H2C2O4、HC2O4-、C2O42-的物质的量分数随pH的变化曲线如图所示,下列叙述正确的是
A.电离常数Ka1(H2C2O4)=10—4.2
B.当滴入10mLNaOH溶液时:c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-)
C.pH=7.0的溶液中:c(Na+)<2c(C2O42-)
D.当滴入20mLNaOH溶液时:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-)
【答案】BD
【解析】
A. pH=4.2时,c(HC2O4-)=c(C2O42-),则 10—4.2,故A错误;
10—4.2,故A错误;
B. 根据电荷守恒,当滴入10mLNaOH溶液时:c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),故B正确;
C. 根据电荷守恒,c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-),pH=7.0的溶液中c(Na+)=c(HC2O4-)+2c(C2O42-),所以c(Na+)>2c(C2O42-),故C错误;
D. 当滴入20mLNaOH溶液时草酸和氢氧化钠恰好反应生成NaHC2O4,根据质子守恒,c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-),故D正确。
答案选BD。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气标准状况,实验记录如表累计值:
时间 | 1 | 2 | 3 | 4 | 5 |
氢气体积 | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大__(填0~1、1~2、2~3、3~4、4~5min)。反应开始后反应速率先增大的原因是__。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率___(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入少量的下列溶液以减慢反应速率,你认为不可行的是__。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

①该反应的化学方程式是__。
②该反应达到平衡状态的标志是__。
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变
D.生成2mol Z的同时生成3mol X