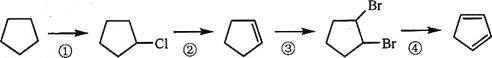
题目内容
【题目】500℃时,在四个体积为2L的恒容密闭容器中发生反应:NO2(g) + SO2(g)![]() SO3(g)+ NO(g)。有关物质起始时的物质的量数据如下表所示:
SO3(g)+ NO(g)。有关物质起始时的物质的量数据如下表所示:
容器 | 起始时物质的量/mol | |||
NO2 | SO2 | SO3 | NO | |
甲 | 0.1 | 0.1 | 0 | 0 |
乙 | 0.15 | 0.05 | 0.05 | 0.05 |
丙 | 0 | 0 | 0.2 | 0.2 |
丁 | 0.1 | 0.2 | 0 | 0 |
已知甲容器达到平衡时容器中c(SO3)=0.01mol·L-1。下列说法正确的是
A.升温至700℃,上述反应的平衡常数为![]() ,则正反应为吸热反应
,则正反应为吸热反应
B.达平衡时,容器丙中c(SO2)是容器甲的2倍
C.达平衡时,容器丁中c(NO)与乙容器中相同
D.保持温度不变容器甲达到平衡时再充入SO2(g)和SO3(g)各0.02mol,此时v(正)>v(逆)
【答案】BC
【解析】
500℃时,甲容器达到平衡时容器中c(SO3)=0.01mol·L-1;

500℃时,![]() 。
。
A. 500℃时,平衡常数是![]() ,升温至700℃,上述反应的平衡常数为
,升温至700℃,上述反应的平衡常数为![]() ,说明升高温度平衡逆向移动,则正反应为放热反应,故A错误;
,说明升高温度平衡逆向移动,则正反应为放热反应,故A错误;
B. 根据“一边倒”原则,丙中相当于投入0.2mol NO2(g) 和0.2mol SO2(g),投料为甲的2倍,相当于加压,加压平衡不移动,达平衡时,所以容器丙中c(SO2)是容器甲的2倍,故B正确;
C. 根据“一边倒”原则,乙相当于都是投入0.2mol NO2(g)和0.1mol SO2(g),与丁是等效平衡关系,因此达平衡时,容器丁中c(NO)与乙容器中相同,故C正确;
D. 保持温度不变,容器甲达到平衡时再充入SO2(g)和SO3(g)各0.02mol, >K,此时v(正)<v(逆),故D错误。
>K,此时v(正)<v(逆),故D错误。
答案选BC。

练习册系列答案
相关题目