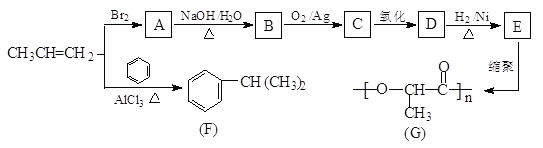
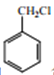
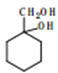
��Ŀ����
����Ŀ�������½�������ʵ�飬����ʵ��������������ó��Ľ�����ȷ����
ѡ�� | ʵ����������� | ���� |
A | ��Zn��ϡ���ᷴӦ��ȡ��������ӦҺ�е��뼸��CuSO4��Һ���������ݵ��������Լӿ� | Cu2+�Ƿ�Ӧ�Ĵ��� |
B | ����з�̪��1mL0.1mol��L��1Na2CO3��Һ�м�ˮϡ����10mL����ɫ��dz | ��ˮϡ��ʱ��CO32����ˮ��ƽ�����淴Ӧ�����ƶ� |
C | ��5 mL 0.1 mol��L��1 KI��Һ�м���0.1 mol��L��1 FeCl3��Һ1 mL�����ñ���ȡ2��3�κ�ȡ�²���Һ�μ�5��KSCN��Һ������Ѫ��ɫ | ��Ӧ2Fe3����2I����2Fe2����I2����һ���ȵ� |
D | ��Na2CO3��Һ�м�����BaSO4��ĩ�����ˣ���ϴ���ij����м�ϡ���������ݲ��� | Ksp(BaCO3)��Ksp(BaSO4) |
A.AB.BC.CD.D
���𰸡�C
��������
A. п�û�������ͭ�е�ͭ��п��ͭ�����ṹ��ԭ��أ��ӿ�п������ķ�Ӧ���ʣ���A����
B.��ˮ�ٽ���ˮ�⣬��ˮϡ��ʱ��CO32����ˮ��ƽ��������Ӧ�����ƶ�����B����
C. ��5 mL 0.1 mol��L��1 KI��Һ�м���0.1 mol��L��1 FeCl3��Һ1 mL��������Ӧ2Fe3����2I����2Fe2����I2��I���������μ�5��KSCN��Һ������Ѫ��ɫ��˵����Fe3��ʣ�࣬��Ӧ2Fe3����2I����2Fe2����I2����һ���ȵģ���C��ȷ��
D.�����ܶȻ�����![]() ��������̼�ᱵ��������Na2CO3��Һ�м�����BaSO4��ĩ����̼�ᱵ���ɣ�����֤��Ksp(BaCO3)��Ksp(BaSO4)����D����
��������̼�ᱵ��������Na2CO3��Һ�м�����BaSO4��ĩ����̼�ᱵ���ɣ�����֤��Ksp(BaCO3)��Ksp(BaSO4)����D����
��ѡC��

 ������ϵ�д�
������ϵ�д� �żӾ���ϵ�д�
�żӾ���ϵ�д�