【题目】下表是元素周期表的一部分,回答问题:
① | |||||||
② | |||||||
③ | ④ | ⑤ | |||||
⑥ |
(1)①和②形成的最简单化合物的结构式是__________,该分子的空间构型是________。
(2)⑤元素位于元素周期表 ___ ,最外层电子的排布式 _________ ,原子核外有 _______种能量不同的电子。CCl4 是一种常见的有机溶剂,判断其属于 _______ (填“极性”、“非极性”)共价键,_________ 分子(填“极性”、“非极性”)。
(3)某元素3P亚层上只有一个电子,判断其离子与②,⑤离子半径大小 ______ (用微粒符号表示),写出该元素单质与元素③最高价氧化物对应水合物反应的化学方程式:________。
(4)设计一个实验方法:比较⑤与⑥单质氧化性的强弱,填入下表。
实验步骤 | ________ |
实验现象 | ________ |
实验原理 | ________ |
实验结论 | ________ |
【题目】部分中学化学常见元素原子结构及性质如表所示:
序号 | 元素 | 结构及性质 |
A | A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5 | |
B | B原子最外层电子数是内层电子总数的1/5 | |
③ | C | C是常见化肥的主要元素,单质常温下呈气态 |
④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
① | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
② | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
(1)A元素在周期表中的位置为____________________________________________。
(2)B与C形成的化合物的化学式为________,它属于________(填“离子”或“共价”)化合物。
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X与Y的水溶液的实验方法是____________________
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的水溶液显________性,N的结构式为________。
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱____。
(5)有人认为B、D的单质用导线连接后插入氯化钠溶液中可以形成原电池,你认为是否可以,若可以,试写出正极的电极方程式(若认为不行可不写)___________________
【题目】2019年诺贝尔化学奖授予美国和日本的三位科学家,以表彰他们在锂离子电池领域的贡献。某种锂离子电池的工作原理如图所示,工作原理为:LiCoO2+C6![]() Li1-xCoO2+LixC6
Li1-xCoO2+LixC6
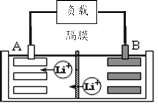
(1)该锂离子电池工作时A为____极,B的电极反应式为____。
(2)废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过实验方法回收钴、锂,实现废旧电池的资源化。
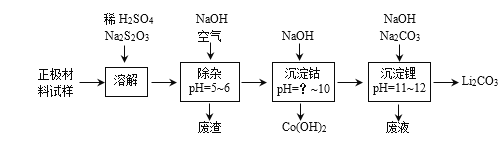
下表列出了几种离子生成氢氧化物沉淀的pH(“开始沉淀”的pH按金属离子浓度为0.1mol·L-1,“沉淀完全”是指溶液中离子浓度低于1.0×10-5 mol·L-1):
Al3+ | Fe3+ | Fe2+ | Co2+ | |
开始沉淀的pH | 4.0 | 2.7 | 7.6 | 7.0 |
沉淀完全的pH | 5.2 | 3.7 | 9.6 | ? |
①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中反应的化学方程式为____。
②除杂过程中,通空气将Fe2+氧化为Fe3+的目的是____。
③沉钴过程中,须调节溶液的pH不低于____。