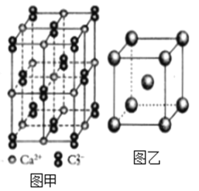
题目内容
【题目】以石油裂解得到的乙烯和1,3-丁二烯为原料,经过下列反应合成高分子化合物H,该物质可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)
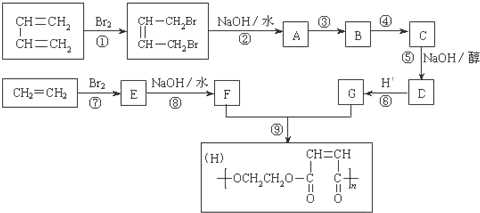
请按要求填空:
(1)写出下列反应的反应类型:反应① ___________ ; 反应⑤ ___________ 。
(2)反应②的化学方程式是:__________ 。
(3)反应③、④中有一反应是与HCl加成,该反应是______(填反应编号),设计这一步反应的目的是_____,物质C的结构简式是_____。
(4)写出与G具有相同种类和数目的官能团的同分异构体:________。
(5)写出由甲苯合成苯甲醛的合成路线________。
【答案】加成反应 消去反应 ![]() +2NaOH
+2NaOH![]()
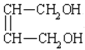 +2NaBr ③ 保护A分子中C=C不被氧化 HOOCCH2CHClCOOH CH2=C(COOH)2
+2NaBr ③ 保护A分子中C=C不被氧化 HOOCCH2CHClCOOH CH2=C(COOH)2 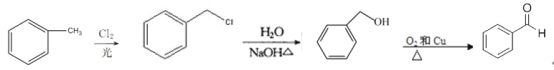
【解析】
1,3-丁二烯与溴发生1,4-加成反应生成1,4-二溴-2-丁烯,再发生卤代烃的水解反应生成A为HOCH2CH=CHCH2OH;乙烯与溴发生加成反应生成E为BrCH2CH2Br,E发生卤代烃的水解反应生成F为HOCH2CH2OH,结合反应⑨生成的高聚物H的结构可知,G为HOOCCH=CHCOOH,该反应为缩聚反应,则D为NaOOCCH=CHCOONa,A系列转化得到G,反应③、④中有一反应是与HCl加成,应是保护碳碳双键,防止被氧化,则反应③为A与HCl发生的加成反应,则B为HOCH2CH2CHClCH2OH,B发生氧化反应生成C为HOOCCH2CHClCOOH,C发生卤代烃的消去反应、中和反应得到D,D酸化生成G。
(1)由上述分析可知,反应①属于加成反应,反应⑤属于消去反应;
(2)反应②为卤代烃的水解,方程式为![]() +2NaOH
+2NaOH![]()
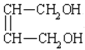 +2NaBr;
+2NaBr;
(3)HOCH2CH=CHCH2OH系列转化得到HOOCCH=CHCOOH,过程中需要被氧化,而碳碳双键也容易被氧化,所以反应③、④中有一反应是与HCl加成,应是保护碳碳双键,防止被氧化,所以要先加成再氧化,即反应③为A与HCl发生的加成反应,则B为HOCH2CH2CHClCH2OH,B发生氧化反应生成C为HOOCCH2CHClCOOH;
(4)G为HOOCCH=CHCOOH,与 G 具有相同种类和数目的官能团的同分异构体为:CH2=C(COOH)2;
(5)甲苯中的甲基可以在光照条件下与卤代烃发生取代反应,之后进行卤原子的取代反应得到醇,醇催化氧化得到醛,所以合成路线为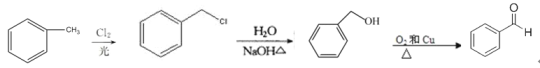 。
。

 阅读快车系列答案
阅读快车系列答案【题目】以下是处于研究阶段的“人工固氮”的新方法.N2在催化剂表面与水发生反应:
2N2(g)+6H2O(l)4NH3(g)+3O2(g) △H="+" 1530.4kJ/mol;完成下列填空:
(1)该反应平衡常数K的表达式_______.
(2)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡,则______.
a.平衡常数K增大
b.H2O的浓度减小
c.容器内的压强增大
d.v逆(O2)减小
(3)研究小组分别在四个容积为2升的密闭容器中,充入N21mol、H2O 3mol,在催化剂条件下进行反应3小时.实验数据见下表:
序号 | 第一组 | 第二组 | 第三组 | 第四组 |
t/℃ | 30 | 40 | 50 | 80 |
NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
第四组实验中以NH3表示反应的速率是_____,与前三组相比,NH3生成量最小的原因可能是______.
(4)氨水是实验室常用的弱碱.
①往CaCl2溶液中通入CO2至饱和,无明显现象.再通入一定量的NH3后产生白色沉淀,此时溶液中一定有的溶质是_____.请用电离平衡理论解释上述实验现象________________________.
②向盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是______.
a.c(C1﹣)=c(NH4+)>c(H+)=c(OH﹣)
b.c(C1﹣)>c(NH4+)=c(OH﹣)>c(H+)
c.c(NH4+)>c(OH﹣)>c(C1﹣)>c(H+)
d.c(OH﹣)>c(NH4+)>c(H+)>c(C1﹣)
【题目】部分中学化学常见元素原子结构及性质如表所示:
序号 | 元素 | 结构及性质 |
A | A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5 | |
B | B原子最外层电子数是内层电子总数的1/5 | |
③ | C | C是常见化肥的主要元素,单质常温下呈气态 |
④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
① | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
② | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
(1)A元素在周期表中的位置为____________________________________________。
(2)B与C形成的化合物的化学式为________,它属于________(填“离子”或“共价”)化合物。
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X与Y的水溶液的实验方法是____________________
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的水溶液显________性,N的结构式为________。
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱____。
(5)有人认为B、D的单质用导线连接后插入氯化钠溶液中可以形成原电池,你认为是否可以,若可以,试写出正极的电极方程式(若认为不行可不写)___________________