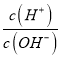题目内容
【题目】比较下列各项中的前者和后者,用“>”、 “<”或“=”填空
(1)熔点:NaCl_______CaO
(2)沸点: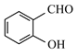 ____
____![]()
(3)在水中的溶解度:SO2_____CO2
(4)酸性:H3PO3_________H3PO4
(5)键能:H—O______ H—S
(6)价电子数:O________Cr
【答案】< < > < > =
【解析】
(1)NaCl中离子所带电荷数为1,CaO中离子所带电荷数为2,且O2-的半径小于Cl-的半径,所以氯化钠的晶格能小于氧化钙的晶格能,所以熔点:NaCl<CaO;
(2)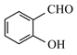 形成分子内氢键,而
形成分子内氢键,而![]() 形成分子间氢键,分子间形成氢键的物质的熔沸点较高,所以沸点:
形成分子间氢键,分子间形成氢键的物质的熔沸点较高,所以沸点: <
<![]() ;
;
(3)SO2分子为V形,结构不对称,属于极性分子,CO2分子为直线形,是非极性分子,水是极性分子,根据相似相溶原理,在水中的溶解度:SO2>CO2;
(4)含氧酸分子的结构中含非羟基(羟基为-OH)氧原子数越多,该含氧酸的酸性越强,所以含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越强,则酸性:H3PO3<H3PO4;
(5)同一主族元素,元素原子半径随着原子序数增大而增大,键长:H-O<H-S,所以键能:H-O>H-S;
(6)O的价层电子排布式为2s22p4,价电子个数为6;Cr的价层电子排布式为3d54s1,价电子个数为6,所以价电子数:O=Cr。

 优学名师名题系列答案
优学名师名题系列答案【题目】某研究性学习小组探究FeSO4的化学性质和用途。回答下列问题:
(一) 探究FeSO4溶液的酸碱性:
(1)取少量FeSO4固体,利用石蕊试液测试FeSO4溶液的酸碱性,必须选用的仪器有胶头滴管、药匙和_____________。
A.玻璃棒 B.试管 C.天平 D.量筒
(二)利用下图装置探究FeSO4的稳定性
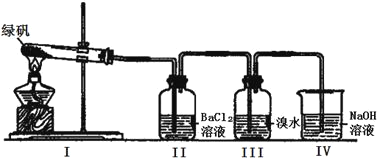
(2)II中有白色沉淀生成,小组成员结合理论分析,认为下列分解产物不可能的是_____________。
A.Fe2O3、SO3、H2O
B.Fe2O3、SO2、SO3、H2O
C.FeO、Fe2O3、SO2、SO3、H2O
(3)III中溴水是用来检验是否有SO2气体生成,若有SO2生成,溴水将褪色。实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是_______。
(4)NaOH的作用是吸收SO2气体,请写出最大量吸收SO2气体的反应化学方程式:_________。
(三)探究FeSO4中Fe2+还原性:
(5)证明FeSO4有较强的还原性,完成下表。
实验步骤 | 实验预期现象及结论 |
步骤一:取少量的FeSO4固体于试管中,加入一定量水溶解。 |
_________________________ |
步骤二:______________ |
(四)硫酸亚铁用途探究
(6)缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是__________________。