题目内容
【题目】2019年诺贝尔化学奖授予美国和日本的三位科学家,以表彰他们在锂离子电池领域的贡献。某种锂离子电池的工作原理如图所示,工作原理为:LiCoO2+C6![]() Li1-xCoO2+LixC6
Li1-xCoO2+LixC6
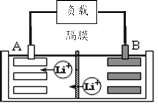
(1)该锂离子电池工作时A为____极,B的电极反应式为____。
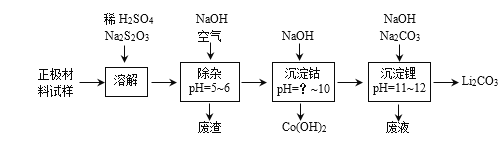
(2)废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过实验方法回收钴、锂,实现废旧电池的资源化。
下表列出了几种离子生成氢氧化物沉淀的pH(“开始沉淀”的pH按金属离子浓度为0.1mol·L-1,“沉淀完全”是指溶液中离子浓度低于1.0×10-5 mol·L-1):
Al3+ | Fe3+ | Fe2+ | Co2+ | |
开始沉淀的pH | 4.0 | 2.7 | 7.6 | 7.0 |
沉淀完全的pH | 5.2 | 3.7 | 9.6 | ? |
①在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中反应的化学方程式为____。
②除杂过程中,通空气将Fe2+氧化为Fe3+的目的是____。
③沉钴过程中,须调节溶液的pH不低于____。
【答案】正 LixC6 —xe—=6C + xLi+ 8LiCoO2 + Na2S2O3 +11H2SO4=4Li2SO4 + 8CoSO4 + Na2SO4 + 11H2O 确保在pH=5~6时将铁元素除尽,且不使Co2+沉淀 9.0
【解析】
(1)根据锂离子移动方向判断正负电极;
(2)①在上述溶解过程中,S2O32-被LiCoO2氧化成SO42-,LiCoO2被还原成Co2+;
②Fe2+在5~6时不能生成氢氧化物沉淀,Fe3+在5~6时完水解成氢氧化铁沉淀;
③根据Co2+开始沉淀的pH计算Co(OH)2的Ksp,再根据“沉淀完全”时Co2+离子浓度低于1.0×10-5 mol·L-1计算氢氧根离子浓度,进而计算pH。
(1)原电池中,阳离子移向正极,根据图示,Li+移向A电极,所以A是正极、B是负极,原电池负极失电子发生氧化反应,B的电极反应式为LixC6 —xe—=6C + xLi+;
(2)①在上述溶解过程中,S2O32-被LiCoO2氧化成SO42-,LiCoO2被还原成Co2+,根据得失电子守恒配平方程式为8LiCoO2 + Na2S2O3 +11H2SO4=4Li2SO4 + 8CoSO4 + Na2SO4 + 11H2O;
②Fe2+在5~6时不能生成氢氧化物沉淀,Fe3+在5~6时完水解成氢氧化铁沉淀,通空气将Fe2+氧化为Fe3+的目的是确保在pH=5~6时将铁元素除尽,且不使Co2+沉淀;
③Co2+开始沉淀的pH为7,则Ksp[Co(OH)2]=![]() ,“沉淀完全”时Co2+离子浓度低于1.0×10-5 mol·L-1,
,“沉淀完全”时Co2+离子浓度低于1.0×10-5 mol·L-1,![]() ,
,![]() ,所以pH不低于9。
,所以pH不低于9。

【题目】下表是元素周期表的一部分,回答问题:
① | |||||||
② | |||||||
③ | ④ | ⑤ | |||||
⑥ |
(1)①和②形成的最简单化合物的结构式是__________,该分子的空间构型是________。
(2)⑤元素位于元素周期表 ___ ,最外层电子的排布式 _________ ,原子核外有 _______种能量不同的电子。CCl4 是一种常见的有机溶剂,判断其属于 _______ (填“极性”、“非极性”)共价键,_________ 分子(填“极性”、“非极性”)。
(3)某元素3P亚层上只有一个电子,判断其离子与②,⑤离子半径大小 ______ (用微粒符号表示),写出该元素单质与元素③最高价氧化物对应水合物反应的化学方程式:________。
(4)设计一个实验方法:比较⑤与⑥单质氧化性的强弱,填入下表。
实验步骤 | ________ |
实验现象 | ________ |
实验原理 | ________ |
实验结论 | ________ |
【题目】下表是元素周期表中的部分元素,请回答下列有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)写出下列元素的符号:①______,⑥______,⑦______。
(2)上述表中的元素中,最活泼的金属元素是______(填元素符号,下同),非金属性最强的元素是______,最不活泼的元素是______。
(3)上述表中元素的最高价氧化物对应的水化物中,酸性最强的是______(填化学式,下同),碱性最强的是______,属于两性氢氧化物的是______,写出这三种物质之间相互反应的化学方程式:______,______,______。
(4)上述表中的元素(不考虑0族元素)中,原子半径最小的是______(填元素符号,下同),原子半径最大的是______。
(5)在③与④中,化学性质较活的是______(填元素符号);在⑧与中,其单质的氧化性较强的是______(填元素符号),请设计实验加以证明:______。