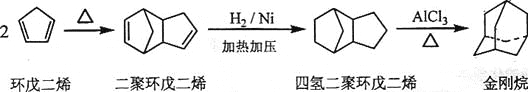
题目内容
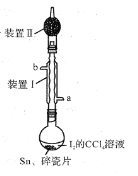
【题目】实验室制取少量溴乙烷的装置如图所示。根据题意完成下列填空:
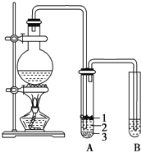
(1)圆底烧瓶中加入的反应物是溴化钠、乙醇 和1:1的硫酸。配制体积比1:1的硫酸所用的仪器为 ________(选填编号)。
a 天平 b 量筒 c 容量瓶 d 烧杯
(2)写出加热时烧瓶中发生的主要反应的化学方程式 ___________________ 。
(3)将 生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是________,试管A中的物质分为三层(如图所示),产物在第____层。
(4)试管A中除了产物和水之外,还可能存在 ________ ,_________ (写出结构简式)。
(5)用浓硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的最佳方法是 ___________(选填编号)。
a 蒸馏 b 氢氧化钠溶液洗涤 c 用四氯化碳萃取 d 用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质名称是_________。
(6)实验员老师建议把上述装置中的仪器连接部分由橡胶管改成标准玻璃接口,其原因_________。
【答案】b NaBr+H2SO4+CH3CH2OH![]() CH3CH2Br+NaHSO4+H2O 冷凝、液封溴乙烷 3 CH2=CH2 CH3CH2OCH2CH3 d 乙烯 反应会产生Br2,腐蚀橡胶
CH3CH2Br+NaHSO4+H2O 冷凝、液封溴乙烷 3 CH2=CH2 CH3CH2OCH2CH3 d 乙烯 反应会产生Br2,腐蚀橡胶
【解析】
实验原理为圆底烧瓶中加入的反应物是溴化钠、乙醇和1:1的硫酸,加热进行反应制备溴乙烷,制备原理为:NaBr+H2SO4+CH3CH2OH![]() CH3CH2Br+NaHSO4+H2O,试管A中加入冰水冷凝液封得到溴乙烷,试管B对产物的成分进行探究验证。
CH3CH2Br+NaHSO4+H2O,试管A中加入冰水冷凝液封得到溴乙烷,试管B对产物的成分进行探究验证。
(1)配制体积比1:1的硫酸所用的仪器为量筒,答案选b;
(2)加热时烧瓶中发生的主要反应的化学方程式为NaBr+H2SO4+CH3CH2OH![]() CH3CH2Br+NaHSO4+H2O;
CH3CH2Br+NaHSO4+H2O;
(3)冰水混合物可以起到冷却的作用,生成的溴乙烷和水互不相溶,并且溴乙烷的密度比水大,在冰水混合物的下层,所以也可液封溴乙烷,防止其挥发,产物在第3层;
(4)反应过程中会有HBr生成,在加热条件下反应,HBr和CH3CH2OH都易挥发,故生成物中可能有HBr、CH3CH2OH;乙醇在浓硫酸加热的条件可以发生消去反应生成CH2=CH2,也可以分子间脱水生成CH3CH2OCH2CH3,即产物中也可能存在CH2=CH2,CH3CH2OCH2CH3;
(5)试管A中获得的有机物呈棕黄色,是由于浓硫酸具有强氧化性,将HBr氧化物Br2,产物为溴乙烷,混有单质溴,蒸馏不能完全除去杂质,并且操作麻烦;氢氧化钠溶液易使溴乙烷水解;四氯化碳会引入新的杂质;而亚硫酸钠和溴发生氧化还原反应生成HBr和硫酸钠,易与溴乙烷分离,所以d正确;乙醇在浓硫酸加热的条件可以发生消去反应生成CH2=CH2,乙烯可以使高猛酸钾溶液褪色;
(6)浓硫酸具有强氧化性,将HBr氧化物Br2,生成的Br2具有强氧化性,会腐蚀橡胶,应用玻璃导管。