【题目】活性氧化锌是一种多功能性的新型无机材料.某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如下:
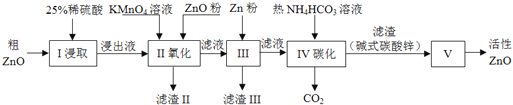
已知各相关氢氧化物沉淀pH范围如下表所示:
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
完成下列填空
(1)步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,所需的仪器除玻璃棒、烧杯外,还需要_______(选填编号)
A.电子天平 B.量筒 C.容量瓶 D.胶头滴管
(2)步骤II中通过加入KMnO4氧化,并用ZnO调节pH,可以除去含铁杂质.检验沉淀是否完全的实验操作是_________.调节pH的适宜范围是_________.
(3)步骤III中加入Zn粉的作用是:①________;②进一步调节溶液pH.
(4)步骤IV中使用热NH4HCO3溶液能促进Zn2+转化为沉淀,但温度不宜过高,其原因可能是________.
(5)步骤V在_______(填仪器名称)中进行,已知碱式碳酸锌的化学式为Zn5(OH)6(CO3)2,请写出发生反应的化学方程式:________.判断已分解完全的操作是________.
(6)用如下方法测定所得活性氧化锌的纯度:
①取1.000g活性氧化锌,用15.00mL 1.000mol/L硫酸溶液完全溶解
②用浓度为0.500mol/L的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL.
假设杂质不参与反应,则所得活性氧化锌的纯度为_______.若在滴定时,实际操作中过量半滴(1mL溶液为25滴),则本次滴定的相对误差为_____.
【题目】从含锌矿渣中提取制备锌白(ZnO)有多种方法,其中氨一碳酸氢铵法的优点是成本低。请根据以下材料,回答问题:
材料1:某矿渣的主要成份为ZnO、Fe2O3、PbO、MnO、CuO、SiO2。
材料2:主要反应原理:ZnO+NH4HCO3+3NH3=Zn(NH3)4CO3 + H2O,类似的也可以生成[Cu(NH3)4] 2+、 [Pb(NH3)4]2+这样的络合离子,这些络合离子中的金属元素同样可以被置换出来,同时锰元素会随着金属锌一起进入浸出液中。
材料3:相关阳离子的氢氧化物的Ksp数据如表所示(室温):
阳离子 | Fe2+ | Mn2+ | Pb2+ | Fe3+ | Mn4+ | Pb4+ |
Ksp | 8.0×10-16 | 4.0×10-14 | 1.2×10-15 | 4.0×10-38 | 1.9×10-13 | 3.2×10-66 |
材料4:可选氧化剂与还原剂:
编号 | A | B | C | D |
氧化剂 | 氯气 | 35%过氧化氢 | 过氧化钠 | 酸性高锰酸钾溶液 |
还原剂 | 镁粉 | 铝粉 | 碳粉 | 锌粉 |
材料5:基本工艺(部分):
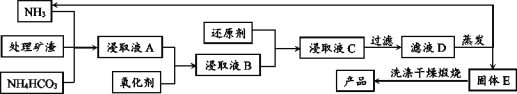
(1)加入氧化剂最好应选择材料4中的_______(填编号);后又加入还原剂的目的是还原溶液中的[Cu(NH3)4]2+、[Pb(NH3)4]2+等离子,请在材料4中选择合适的还原剂写出其中一个离子方程式_______.
(2)对滤液D的蒸发在工艺流程上也叫“蒸氨”,此过程中得到一种碱式盐沉淀物和两种气体,产生的气体可以在经过碱石灰处理后得到纯净而干燥的氨气。固体E经洗涤干燥后,灼烧得到产品,并产生水和CO2。则“蒸氨”过程中发生的化学反应方程式可表述为_______。
【题目】过氧化尿素广泛应用与农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:CO(NH2)2+H2O2 ![]() CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
合成过氧化尿素的流程如下:
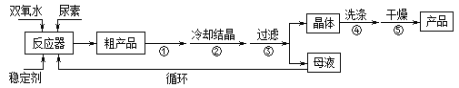
请回答下列问题:
(1)该反应的温度不能过低或过高的原因是___________
(2)步骤①宜采用的操作是____________。
(3)称取10.0g产品溶解在250mL蒸馏水中,移取25mL溶解后的溶液于锥形瓶中,再加2mL6mol·L﹣1H2SO4,用0.2000mol·L﹣1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应).
①配制0.2000mol·L﹣1KMnO4 标准溶液不需要用到的仪器有_______(填编号)
a.托盘天平 b.电子天平 c. 滴定管 d. 烧杯 e. 锥形瓶 f. 玻璃棒 g. 胶头滴管
②用0.2000mol·L﹣1KMnO4标准溶液滴定,其中正确操作步骤的顺序为_________
a. 用移液管取用25mL待测溶液于锥形瓶中
b. 把盛有KMnO4标准液的滴定管固定好,调节滴定管尖嘴使之充满液体
c. 取KMnO4标准液注入滴定管中至“0”刻度以上
d. 调节液面至“0”或“0”刻度以下,记下读数 e.把锥形瓶放在滴定管下面,用标准KMnO4液滴定至终点并记下滴定管的读数
③下列操作中的说法正确的是_________
A. KMnO4标准溶液放在酸式滴定管中
B. 滴定前,锥形瓶必须用待装液润洗
C. 滴定过程中需要用酚酞作指示剂
D. 滴定操作中,如果滴定前装有KMnO4标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将偏大
④为提高该滴定结果的精密度和准确度,可采取的措施是__________
A.稀释被测试样 B.减少被测试样取量
C.增加平行测定次数 D.降低滴定剂浓度
【题目】甲醇是一种用途广泛的化工原料,也可作为燃料。请回答以下问题:
(1)工业上常用下列反应制备甲醇:CO(g) + 2H2(g) ![]() CH3OH(g) ΔH= —90.1KJmol-1,该反应自发的条件是________。
CH3OH(g) ΔH= —90.1KJmol-1,该反应自发的条件是________。
(2)实验室模拟用CO和H2反应来制甲醇。在250℃下,将一定量的CO和H2投入2L的密闭容器中,各物质的物质的量(mol)变化如下表所示:(前6min没有改变条件)
2min | 4min | 6min | 8min | 20min | … | |
CO | 0.7 | 0.5 | 0.5 | 0.4 | 0.2 | … |
H2 | 1.4 | 1 | 1 | 1.8 | 2 | … |
CH3OH | 0.3 | 0.5 | 0.5 | 0.6 | 0.8 | … |
①从0min-4min这段时间的反应速率v(CO)=_________
②250℃时该反应平衡常数K的值为________。
③若第6min时只改变了一个条件,则所改变的条件是________。
④若反应过程中保持温度不变,第20min时,该反应的v正______v逆。(填“ > ”,“ < ”或“ = ”)
(3)若在一恒容的密闭容器中通入物质的量之比为1:1的CO和H2来生产CH3OH,画出不同温度下,反应相同时间时CO的体积分数随温度变化的图像。_______________