��Ŀ����
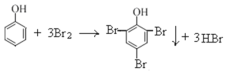
����Ŀ�����������ع㷺Ӧ����ũҵ��ҽҩ�����û����������õ�Ũ�ȵ�˫��ˮ�ͱ���������Һ��һ�������¿��Ժϳɹ��������ء���Ӧ�ķ���ʽΪ��CO(NH2)2+H2O2 ![]() CO(NH2)2��H2O2�����������صIJ����������£�
CO(NH2)2��H2O2�����������صIJ����������£�
����ʽ | ��� | �ȷֽ��¶� | �۵� | �ܽ��� |
CO(NH2)2��H2O2 | ��ɫ���� | 45�� | 75��85�� | ������ˮ���л��ܼ� |
�ϳɹ��������ص��������£�
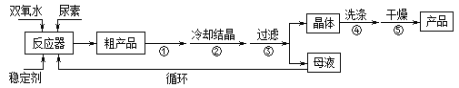
��ش��������⣺
��1���÷�Ӧ���¶Ȳ��ܹ��ͻ���ߵ�ԭ����___________
��2��������˲��õIJ�����____________��
��3����ȡ10.0g��Ʒ�ܽ���250mL����ˮ�У���ȡ25mL�ܽ�����Һ����ƿ�У��ټ�2mL6mol��L��1H2SO4����0.2000mol��L��1KMnO4����Һ�ζ����յ�ʱ����18.00mL��������KMnO4��Һ����Ӧ��.
������0.2000mol��L��1KMnO4 ����Һ����Ҫ�õ���������_______�����ţ�
a.������ƽ b.������ƽ c. �ζ��� d. �ձ� e. ��ƿ f. ������ g. ��ͷ�ι�
����0.2000mol��L��1KMnO4����Һ�ζ���������ȷ���������˳��Ϊ_________
a. ����Һ��ȡ��25mL������Һ����ƿ��
b. ��ʢ��KMnO4��Һ�ĵζ��̶ܹ��ã����ڵζ��ܼ���ʹ֮����Һ��
c. ȡKMnO4��Һע��ζ���������0���̶�����
d. ����Һ������0������0���̶����£����¶��� e.����ƿ���ڵζ������棬�ñ�KMnO4Һ�ζ����յ㲢���µζ��ܵĶ���
�����в����е�˵����ȷ����_________
A. KMnO4����Һ������ʽ�ζ�����
B. �ζ�ǰ����ƿ�����ô�װҺ��ϴ
C. �ζ���������Ҫ�÷�̪��ָʾ��
D. �ζ������У�����ζ�ǰװ��KMnO4����Һ�ĵζ��ܼ��첿�������ݣ����ζ�������������ʧ����ⶨ�����ƫ��
��Ϊ��߸õζ�����ľ��ܶȺ�ȷ�ȣ��ɲ�ȡ�Ĵ�ʩ��__________
A��ϡ�ͱ������� B�����ٱ�������ȡ��
C������ƽ�вⶨ���� D�����͵ζ���Ũ��
���𰸡��¶ȹ�������̫�����¶ȹ���˫��ˮ�������������ȷֽ� �����������ѹ���� ace cbdae AD CD
��������
��1���ӷ�Ӧ���ʺ����ʵ��ȶ��Է�����
��2�����ݲ�Ʒ�ķֽ��¶Ƚϵͣ�����������˲��õIJ�����
��3���ٸ�������0.2000mol��L��1KMnO4 ����Һ�IJ��������Ҫ��������
�ڸ��ݵζ������Ĺ淶Ҫ��ش�
��A. KMnO4����ǿ�����ԣ���ʴ��
B. �ζ�ǰ������ƿ�ô�װҺ��ϴ������ƿ���������ʵ���ƫ��
C. ���������Һ��������ɫ��
D. �ζ������У�����ζ�ǰװ��KMnO4����Һ�ĵζ��ܼ��첿�������ݣ����ζ�������������ʧ�������ĸ��������Һ�����ƫ��
��Ϊ��߸õζ�����ľ��ܶȺ�ȷ�ȣ������ظ�����ʵ�飬��ֵȡƽ��ֵ���������ζ���ҺŨ��ԽС���ⶨ���Խȷ��
(1). �¶ȹ�������̫�����¶ȹ���˫��ˮ�������������ȷֽ⣬���Ը÷�Ӧ���¶Ȳ��ܹ��ͻ���ߣ�
��2����Ʒ�ڽϵ��¶��¾��ֽܷ⣬���Բ�����˲��õIJ����Ǽ�ѹ������
��3��������0.2000mol��L��1KMnO4 ����Һ�������Ǽ��������ص��������õ�����ƽ�Ƴ���Ҫ�ĸ�����أ����ձ����ܽ⣬�ò���������ӿ��ܽ����ʣ���ȴ�����º��ò�����������������ƿ�У���ˮ���ݣ���Һ����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ����ҡ�ȣ����Բ���Ҫ��������������ƽ���ζ��ܡ���ƿ����ѡace��
����0.2000mol��L��1KMnO4����Һ�ζ���������ȷ���������˳��Ϊcbdae��
c. ȡKMnO4��Һע��ζ���������0���̶����ϣ�
b. ��ʢ��KMnO4��Һ�ĵζ��̶ܹ��ã����ڵζ��ܼ���ʹ֮����Һ�壻
d. ����Һ������0������0���̶����£����¶�����
a. ����Һ��ȡ��25mL������Һ����ƿ�У�
e.����ƿ���ڵζ������棬�ñ�KMnO4Һ�ζ����յ㲢���µζ��ܵĶ�����
��A. KMnO4����ǿ�����ԣ���ʴ�����Ա���Һ������ʽ�ζ����У���A��ȷ��
B. �ζ�ǰ������ƿ�ô�װҺ��ϴ������ƿ���������ʵ���ƫ�����Եζ�ǰ����ƿ�����ô�װҺ��ϴ����B����
C. ���������Һ��������ɫ���ζ������в����ָʾ������C����
D. �ζ������У�����ζ�ǰװ��KMnO4����Һ�ĵζ��ܼ��첿�������ݣ����ζ�������������ʧ�������ĸ��������Һ�����ƫ����ⶨ�����ƫ��D��ȷ��ѡAD��
��A.ϡ�ͱ�����������Ӱ��ⶨ�������A����
B.���ٱ�������ȡ�����͵ζ�����ľ��ܶȺ�ȷ���أ���B����
C.����ƽ�вⶨ��������ֵȡƽ��ֵ�����ٲⶨ���������������ȷ�ȣ���C��ȷ;
D.���͵ζ���Ũ�ȣ���Ӧ�յ��жϸ�ȷ���ζ�����ľ��ܶȸߣ���D��ȷ��ѡCD��

����Ŀ����ش���������
��1��ij�¶�ʱ�����pH��11��Ba(OH)2��ҺŨ����0.005mol��L��1��
�ٸ��¶���ˮ�����ӻ�����Kw��________��
���ڴ��¶��£���pH��12��Ba(OH)2��ҺVa L��pH��2������Vb L��ϡ������û��ҺΪ���ԣ���Va��Vb��________��
��2��25 ��ʱ���������ʵĵ���ƽ�ⳣ�����±���ʾ����ش��������⣺
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1.8��10��5 | K1��4.3��10��7 K2��5.6��10��11 | 3.0��10��8 |
������˵����ȷ����__________
A��25 ��ʱ����CH3COOH��Һ�м���������NaOH��Һ��CH3COOH�ĵ���̶�������ƽ�ⳣ������
B��0.1molL-1 CH3COOH��Һ��ˮϡ�ͣ�ϡ�ͺ����Һ��ˮ�ĵ���̶ȼ�С
C��0.1molL-1 HClO��Һ��0.1molL-1 NaClO��Һ�������ϳ���Һ����
D��̼��������Һ������������Ŀ���
�� ͬŨ�ȵ�CH3COO����HCO��CO32-��ClO�����H����������ǿ������˳��Ϊ___
�� 25 ��ʱ��ijCH3COOH��CH3COOK�����Һ�����ԣ���û����Һ�У�![]() =________
=________
��3��úȼ���ŷŵ���������SO2��NO�����ü��Ե�NaClO2��Һ��Ϊ���ռ���ͬʱ���������������������ڹ��ݷ�Ӧ����ͨ�뺬��SO2��NO����������Ӧ�¶�Ϊ323 K��NaClO2��ҺŨ��Ϊ5��103mol��L1����Ӧ10min����Һ������Ũ�ȵķ���������±���
���� | SO42 | SO32 | NO3 | NO2 | Cl |
c/��mol��L1�� | 8.35��104 | 6.87��106 | 1.5��104 | 1.2��105 | 3.4��103 |
��д��NaClO2��Һ������������Ҫ��Ӧ�����ӷ���ʽ______��
���������Ca(ClO)2���NaClO2��������Ч������á��Դӻ�ѧƽ��ԭ��������Ca(ClO)2���NaClO2���е��ŵ���________��
����Ŀ��̼�����̼����ض�����Ҫ�Ļ�ѧ�Լ��빤ҵԭ�ϣ����й㷺����;��
��1����̼��ء�ʯ��ʯ�Ͷ���������и������գ��ɵõ����ΪK2OCaO6SiO2�ļز�����ͬʱ�ų�CO2��������5.1kg�ز������ŷŵ�CO2�ڱ�״���µ������_____L��
��2����֪�����������ǿ��̼�ᣮ��ҵ����̼�����̼����صĻ����Һ����SO2����ַ�Ӧ��������Һ������±���
���� | K2CO3 | KHCO3 | K2SO3 |
������kg�� | 55.2 | 120.0 | 63.2 |
����ԭ����Һ��̼�����̼����ص����ʵ���֮��_______________��
��3�������ϱ��е����ݣ������ϱ��Ļ����Һ��������SO2���������������SO2���ܽ⣩��_____________
��4�����ȵ�ŨCuSO4��Һ��K2CO3��Һ��ϣ�����������һ����ɫ��״���壨�����ᾧˮ����ʽ��Ϊ376�����м�Ԫ�ص���������Ϊ0.104��ȡ0.02mol�þ�������������ϡ�����У�û������������ټ���BaCl2������9.32g��ɫ������ͨ�������ƶϾ���Ļ�ѧʽ��___