题目内容
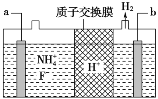
【题目】常温下,某溶液中由水电离出的c(H+)=l ×10-13 mol·L-1,下列说法正确的是
A.在该溶液中一定能同时大量存在Cu2+、NO3-、Cl-、Na+等离子
B.在该溶液中有可能同时大量存在K+、NO3-、HCO3-、Na+等离子
C.该溶液的pH可能为13,也可能为1
D.该溶液中 c(OH-)=l×10-1 mol·L-1
【答案】C
【解析】
常温下,纯水中由水电离出的c(H+)=l ×10-7mol·L-1,而该溶液中由水电离出的c(H+)=l ×10-13 mol·L-1,说明水的电离受到抑制,其抑制原因可能是溶液中存在大量H+或OH-,即溶液可能为酸性,也可能为碱性,据此分析。
A.若该溶液中存在大量OH-,Cu2+与OH-会反应生成Cu(OH)2沉淀,不能大量共存,若溶液中存在大量H+,Cu2+、NO3-、Cl-、Na+等离子与H+均不发生反应能够大量共存,故A不符合题意;
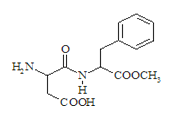
B.![]() 与H+或OH-均不能大量共存,因此在该溶液中一定不能大量共存,故B不符合题意;
与H+或OH-均不能大量共存,因此在该溶液中一定不能大量共存,故B不符合题意;
C.若该溶液中H+全部由水电离,则溶液中c(H+)=l ×10-13 mol·L-1,溶液pH=13,若溶液中OH-全部由水电离,即溶液中c(OH-)=l ×10-13 mol·L-1,溶液中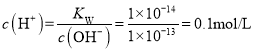 ,溶液pH=1,故C符合题意;
,溶液pH=1,故C符合题意;
D.由C分析可知,溶液中c(OH-)=l ×10-13 mol·L-1或c(OH-)=0.1 mol·L-1,故D不符合题意;
故答案为:C。

【题目】制烧碱所用盐水需两次精制。
第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水。
已知:过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如表:
完成下列填空:
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
(1)过程Ⅰ除去的离子是_______________。
(2)检测Fe3+是否除尽的方法是____________________。
(3)过程Ⅰ选用BaCl2而不选用CaCl2,请运用表中数据解释原因______________。
(4)除去Mg2+的离子方程式是________________。
(5)检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是_____________。
第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如图:
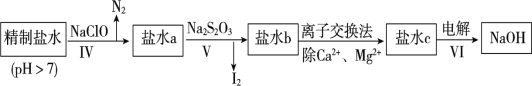
(6)过程Ⅳ除去的离子是__________________。
(7)过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释___________。
【题目】从含锌矿渣中提取制备锌白(ZnO)有多种方法,其中氨一碳酸氢铵法的优点是成本低。请根据以下材料,回答问题:
材料1:某矿渣的主要成份为ZnO、Fe2O3、PbO、MnO、CuO、SiO2。
材料2:主要反应原理:ZnO+NH4HCO3+3NH3=Zn(NH3)4CO3 + H2O,类似的也可以生成[Cu(NH3)4] 2+、 [Pb(NH3)4]2+这样的络合离子,这些络合离子中的金属元素同样可以被置换出来,同时锰元素会随着金属锌一起进入浸出液中。
材料3:相关阳离子的氢氧化物的Ksp数据如表所示(室温):
阳离子 | Fe2+ | Mn2+ | Pb2+ | Fe3+ | Mn4+ | Pb4+ |
Ksp | 8.0×10-16 | 4.0×10-14 | 1.2×10-15 | 4.0×10-38 | 1.9×10-13 | 3.2×10-66 |
材料4:可选氧化剂与还原剂:
编号 | A | B | C | D |
氧化剂 | 氯气 | 35%过氧化氢 | 过氧化钠 | 酸性高锰酸钾溶液 |
还原剂 | 镁粉 | 铝粉 | 碳粉 | 锌粉 |
材料5:基本工艺(部分):
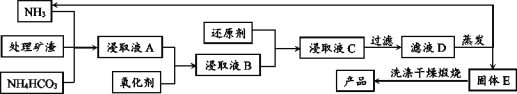
(1)加入氧化剂最好应选择材料4中的_______(填编号);后又加入还原剂的目的是还原溶液中的[Cu(NH3)4]2+、[Pb(NH3)4]2+等离子,请在材料4中选择合适的还原剂写出其中一个离子方程式_______.
(2)对滤液D的蒸发在工艺流程上也叫“蒸氨”,此过程中得到一种碱式盐沉淀物和两种气体,产生的气体可以在经过碱石灰处理后得到纯净而干燥的氨气。固体E经洗涤干燥后,灼烧得到产品,并产生水和CO2。则“蒸氨”过程中发生的化学反应方程式可表述为_______。