题目内容
【题目】将浓度为0.05mol/L的HClO溶液加水不断稀释,下列各量始终保持增大的是
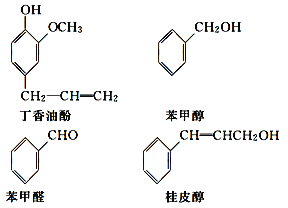
A.c(H+)B. ![]() C.Ka(HClO)D.
C.Ka(HClO)D.![]()
【答案】B
【解析】
A.因HClO为弱酸,则浓度为0.05mol/L的HClO溶液加水不断稀释,促进电离,平衡正向移动,电离程度增大,n(H+)增大,但c(H+)不断减小,故A不符合题意;
B.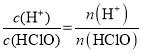 ,加水稀释过程中,促进HClO电离,n(H+)增大,n(HClO)减小,
,加水稀释过程中,促进HClO电离,n(H+)增大,n(HClO)减小,![]() 将增大,故B符合题意;
将增大,故B符合题意;
C.因电离平衡常数只与温度有关,温度不变的情况下,Ka(HClO)不变,故C不符合题意;
D.稀释过程中,稀释过程中,c(H+)与c(ClO-)均减小,酸的浓度逐渐减小,水的电离程度逐渐增大,水电离出的H+逐渐增加,即溶液中c(H+)的变化幅度小于c(ClO-),故![]() 比值将减小,故D不符合题意;
比值将减小,故D不符合题意;
故答案为:B。

【题目】过氧化尿素广泛应用与农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:CO(NH2)2+H2O2 ![]() CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
合成过氧化尿素的流程如下:
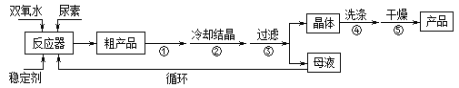
请回答下列问题:
(1)该反应的温度不能过低或过高的原因是___________
(2)步骤①宜采用的操作是____________。
(3)称取10.0g产品溶解在250mL蒸馏水中,移取25mL溶解后的溶液于锥形瓶中,再加2mL6mol·L﹣1H2SO4,用0.2000mol·L﹣1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应).
①配制0.2000mol·L﹣1KMnO4 标准溶液不需要用到的仪器有_______(填编号)
a.托盘天平 b.电子天平 c. 滴定管 d. 烧杯 e. 锥形瓶 f. 玻璃棒 g. 胶头滴管
②用0.2000mol·L﹣1KMnO4标准溶液滴定,其中正确操作步骤的顺序为_________
a. 用移液管取用25mL待测溶液于锥形瓶中
b. 把盛有KMnO4标准液的滴定管固定好,调节滴定管尖嘴使之充满液体
c. 取KMnO4标准液注入滴定管中至“0”刻度以上
d. 调节液面至“0”或“0”刻度以下,记下读数 e.把锥形瓶放在滴定管下面,用标准KMnO4液滴定至终点并记下滴定管的读数
③下列操作中的说法正确的是_________
A. KMnO4标准溶液放在酸式滴定管中
B. 滴定前,锥形瓶必须用待装液润洗
C. 滴定过程中需要用酚酞作指示剂
D. 滴定操作中,如果滴定前装有KMnO4标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将偏大
④为提高该滴定结果的精密度和准确度,可采取的措施是__________
A.稀释被测试样 B.减少被测试样取量
C.增加平行测定次数 D.降低滴定剂浓度