题目内容
【题目】氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜。
(1)现有8克氧化铜被氢气还原后,得到红色固体6.8克,其中含单质铜与氧化亚铜的物质的量之比是_________;
(2)若将6.8克上述混合物与足量的稀硫酸充分反应后过滤,可得到固体__________克;
(3)若将6.8克上述混合物与一定量的浓硝酸充分反应;
①生成标准状况下1.568升的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是___________,其物质的量之比是_____________;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤,得晶体23.68克.经分析,原溶液中的Cu2+有20%残留在母液中.求所得晶体的化学式为____________________。
【答案】2:1 4.8 NO、NO2 4:3 Cu(NO3)2·6H2O
【解析】
(1)氧化铜和氢气反应生成铜和氧化亚铜、水,所以固体减少的质量为氧元素的质量,根据剩余氧元素的质量计算氧化亚铜的物质的量,再根据元素守恒计算铜的物质的量;
(2)根据铜的物质的量计算铜的质量,从而得出氧化亚铜的质量,再根据反应方程式计算氧化亚铜生成铜的质量,两部分铜的质量即为固体的质量;
(3)①采用极限法判断气体的成分,然后列方程式组求出一氧化氮和二氧化氮的物质的量之比;
②先根据铜元素守恒计算硝酸铜溶液中铜离子的含量,再根据题意判断晶体中铜离子的含量,从而得出硝酸铜的物质的量,总质量减去硝酸铜的质量即为水的质量,计算水的物质的量,再根据物质的量之比等于系数之比得出化学式。
(1)n(CuO)= ![]() =0.1mol,氧元素的物质的量=n(CuO)═铜元素的物质的量=0.1mol,固体由CuO生成Cu和Cu2O,减少的质量为氧元素的质量,即8g6.8g=1.2g,减少的氧元素的物质的量=
=0.1mol,氧元素的物质的量=n(CuO)═铜元素的物质的量=0.1mol,固体由CuO生成Cu和Cu2O,减少的质量为氧元素的质量,即8g6.8g=1.2g,减少的氧元素的物质的量=![]() =0.075mol,所以Cu2O中氧元素的物质的量=0.1mol0.075mol=0.025mol,所以n(Cu2O)=0.025mol,根据铜元素守恒得n(Cu)=0.1mol2×0.025mol=0.05mol,所以单质铜与氧化亚铜的物质的量之比是2:1,故答案为:2:1;
=0.075mol,所以Cu2O中氧元素的物质的量=0.1mol0.075mol=0.025mol,所以n(Cu2O)=0.025mol,根据铜元素守恒得n(Cu)=0.1mol2×0.025mol=0.05mol,所以单质铜与氧化亚铜的物质的量之比是2:1,故答案为:2:1;
(2)n(Cu)=0.1mol2×0.025mol=0.05mol,所以m(Cu)=0.05mol×64g/mol=3.2g,氧化亚铜的质量=6.8g3.2g=3.6g,氧化亚铜和稀硫酸反应,铜和稀硫酸不反应,设氧化亚铜和稀硫酸反应生成铜的质量为x.氧化亚铜和稀硫酸反应的方程式为:Cu2O+H2SO4=CuSO4+Cu+H2O,x=![]() =1.6g,所以可得到固体的质量=3.2g+1.6g=4.8克,故答案为:4.8;
=1.6g,所以可得到固体的质量=3.2g+1.6g=4.8克,故答案为:4.8;
(3)①通过②分析知,6.8克的铜和氧化亚铜的混合物与硝酸反应相当于4.8克的铜与硝酸反应。设铜与硝酸反应全部生成二氧化氮,则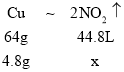 ,二氧化氮的体积为:x=
,二氧化氮的体积为:x=![]() ,设铜与硝酸反应全部生成一氧化氮,则
,设铜与硝酸反应全部生成一氧化氮,则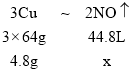 ,一氧化氮的体积为:x=
,一氧化氮的体积为:x=![]() ,1.12L<1.568L<3.36L,所以该气体是二氧化氮和一氧化氮的混合物;设生成一氧化氮的物质的量为ymol,生成二氧化氮的物质的量为zmol,根据反应,有下列关系式:
,1.12L<1.568L<3.36L,所以该气体是二氧化氮和一氧化氮的混合物;设生成一氧化氮的物质的量为ymol,生成二氧化氮的物质的量为zmol,根据反应,有下列关系式:
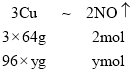 ,
,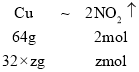 ,联立方程:
,联立方程: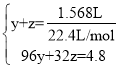 ,解得
,解得![]() ,所以一氧化氮和二氧化氮的物质的量之比为4:3,故答案为:NO、NO2;4:3;
,所以一氧化氮和二氧化氮的物质的量之比为4:3,故答案为:NO、NO2;4:3;
②根据铜元素守恒知,氧化铜中的铜全部转化为硝酸铜中的铜离子,为0.1mol,原溶液中的Cu2+有20%残留在母液中,所以晶体中铜离子的物质的量为0.08mol,根据化学式知,晶体中硝酸铜的物质的量=铜离子的物质的量=0.08mol,m(Cu(NO3)2)=0.08mol×188g/mol=15.04g<23.68g,所以晶体中有水,水的物质的量=![]() =0.48mol,硝酸铜与水的物质的量之比=0.08mol:0.48mol=1:6,所以其化学式为Cu(NO3)26H2O.故答案为Cu(NO3)26H2O。
=0.48mol,硝酸铜与水的物质的量之比=0.08mol:0.48mol=1:6,所以其化学式为Cu(NO3)26H2O.故答案为Cu(NO3)26H2O。

【题目】金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶性金属氢氧化物在不同pH下的溶解度[S(mol·L-1)]如图所示。
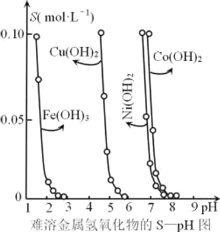
(1)pH=6时溶液中铜元素的主要存在形式是________。
(2)若要除去CuCl2溶液中的少量Fe3+,下列最适宜的pH 范围是_____(选填序号)。
A.<2 B. 3.54.2 C. >6.3
(3)在Ni(OH)2溶液中含有少量的Co2+杂质,_______(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是______.
(4)可用加入氨水的方法使Cu(OH)2沉淀溶解,生成的产物之一为[Cu(NH3)4]2+。该反应的离子方程式为______.
已知一些难溶物的溶度积常数如下表:
物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
(5)某工业废水中含有Cu2+、Pb2+、Hg2+,为除去这些离子,最适宜向此工业废水中加入过量的______(选填序号)。
A.NaOH B.FeS C.Na2S
【题目】钢铁制品经常进行烤蓝处理,即在铁制品的表面生成一层致密的Fe3O4。某学习小组为了研究烤蓝铁片,分别进行了以下实验操作:
①把一定量烤蓝铁片加工成均匀粉末。
②取m g该粉末,放入28.00 mL 1 mol/L的盐酸中,恰好完全反应,生成标准状况下的气体134.4 mL,向溶液中滴入KSCN溶液,无明显现象。
③再取三份不同质量的粉末,分加加到相同体积(V)、物质的量浓度均为l0.00 mol/L的三份硝酸溶液中,充分反应后,固体全部溶解,有关的实验数据如下表所示(假设NO是硝酸的唯一还原产物):
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入粉末质量/g | 13.68 | 27.36 | 34.20 |
生成气体的体积(标准状况)/L | 2.912 | 5.824 | 6.720 |
完成下列各题:
(1)实验②所得溶液中的溶质是_______(写化学式),样品中n(Fe)∶n(Fe3O4)=________,m=____________。
(2)计算实验③中每份硝酸溶液的体积(V)(mL)_________。
(3)若向实验Ⅱ所得溶液中继续加入铜粉,要使溶液中Cu2十、Fe2+、Fe3+同时存在,求加入铜粉的物质的量的范围___________。