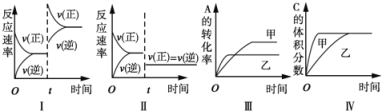
��Ŀ����
����Ŀ����������п��һ�ֶ���Ե����������ϣ�ijС���Դ�����п��������ͭ�������Ϊԭ��ģ�ҵ������������п���������£�
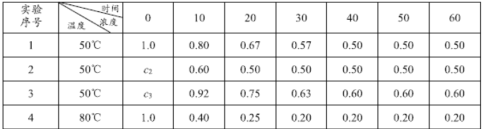
��֪����������������pH��Χ���±���ʾ��
Zn��OH��2 | Fe��OH��2 | Fe��OH��3 | Cu��OH��2 | |
��ʼ����pH | 5.4 | 7.0 | 2.3 | 4.7 |
��ȫ����pH | 8.0 | 9.0 | 4.1 | 6.7 |
����������
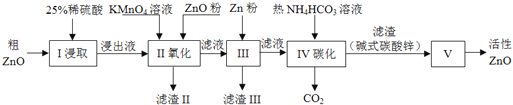
��1������I������25%ϡ�������98%Ũ���ᣨ�ܶ�Ϊ1.84g/mL�����ƣ���������������������ձ��⣬����Ҫ_______��ѡ���ţ�
A��������ƽ B����Ͳ C������ƿ D����ͷ�ι�
��2������II��ͨ������KMnO4����������ZnO����pH�����Գ�ȥ�������ʣ���������Ƿ���ȫ��ʵ�������_________������pH�����˷�Χ��_________��
��3������III�м���Zn�۵������ǣ���________���ڽ�һ��������ҺpH��
��4������IV��ʹ����NH4HCO3��Һ�ܴٽ�Zn2+ת��Ϊ���������¶Ȳ��˹��ߣ���ԭ�������________��
��5������V��_______�����������ƣ��н��У���֪��ʽ̼��п�Ļ�ѧʽΪZn5��OH��6��CO3��2����д��������Ӧ�Ļ�ѧ����ʽ��________���ж��ѷֽ���ȫ�IJ�����________��
��6�������·����ⶨ���û�������п�Ĵ��ȣ�
��ȡ1.000g��������п����15.00mL 1.000mol/L������Һ��ȫ�ܽ�
����Ũ��Ϊ0.500mol/L�ı�����������Һ�ζ�ʣ�����ᣬ�����յ�ʱ��������������Һ12.00mL��
�������ʲ����뷴Ӧ�������û�������п�Ĵ���Ϊ_______�����ڵζ�ʱ��ʵ�ʲ����й�����Σ�1mL��ҺΪ25�Σ����εζ���������Ϊ_____��
���𰸡�bd ȡ������Һ���μ�KSCN��Һ������ɫ�仯 4.1��4.7 ��ȥ��Һ�е�Cu2+ NH4HCO3�ֽ����ʧ ���� Zn5��OH��6��CO3��2![]() 5ZnO+2CO2��+3H2O ���ز��� 97.2% 0.17%
5ZnO+2CO2��+3H2O ���ز��� 97.2% 0.17%
��������
������п(������ͭ��������)����ϡ�����ܽ���˵õ���Һ�к�����������������ͭ������п��������������Һ������������Ϊ�����ӣ���������п������ҺpH���������Ӻ�ͭ���ӣ�����п��ԭͭ����Ϊͭ���ʣ����˵õ�����п��̼������̼����麟���п�������ɼ�ʽ̼��п�����ȷֽ����ɻ�������п��
(1)����I������25%ϡ�������98%Ũ����(�ܶ�Ϊ1.84g/mL)���ƣ��Ǵ����������ձ���ϡ�����ƣ���������������������ձ��⣬����Ҫ��������Ͳ����ͷ�ιܵȣ��ʴ�Ϊ��bd��
(2)��������Ƿ���ȫ���������������������������Һ���ɫ�����֤��ȡ������Һ���μ�KSCN��Һ������ɫ�仯˵��������ȫ�����ݳ���PH��Χ������ҺPHʹ�����Ӻ�ͭ���ӳ�����������ҺPHΪ4.1��4.7��
(3)����III�м���Zn�۵������Ǻ���ͭ���ӣ���һ��������ҺpH����ͭ���ӣ�
(4)����IV��ʹ����NH4HCO3��Һ�ܴٽ�Zn2+ת��Ϊ���������¶Ȳ��˹��ߣ���ԭ�������̼����������ֽ⣻
(5)����ֽ��������н��У���ʽ̼��п�Ļ�ѧʽΪZn5(OH)6(CO3)2���ֽ���������п��������̼��ˮ�����ԭ���غ���ƽ��д�õ���Ӧ�Ļ�ѧ����ʽΪ��Zn5(OH)6(CO3)2![]() 5ZnO+2CO2��+3H2O���ж��ѷֽ���ȫ�IJ����dz��������أ�
5ZnO+2CO2��+3H2O���ж��ѷֽ���ȫ�IJ����dz��������أ�
(6)���ݵζ���������������Һ���ʵ�������ʣ���������ʵ���������õ�������п��Ӧ���������ʵ�������õ�����п���ʵ�����������п��Ӧ�����������ʵ�����0.0150L��1.000mol/L��2��0.500mol/L��0.0120L��0.024mol��ZnO+2H+��Zn2++H2O�����㴿�ȣ�![]() ��100%��97.2%��1mL��ҺΪ25�Σ���ε����Ϊ
��100%��97.2%��1mL��ҺΪ25�Σ���ε����Ϊ![]() mL�������
mL�������![]() ��100%��0.17%��
��100%��0.17%��

 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�