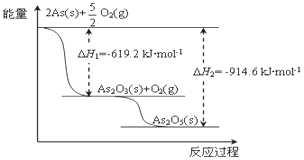
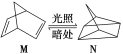
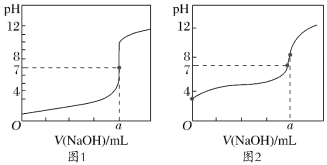
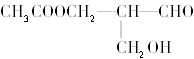【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积Kw | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a__1×10-14(填“>”“<”或“=”)。
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1 mL加水稀释至10mL,则稀释后溶液中c(Na+)∶c(OH-)=__。
(3)在t2℃下pH=10的NaOH溶液中,水电离产生的OH-浓度c(OH-)水=__。
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__。
【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液。称量时,样品可放在___(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000mol·L-1的盐酸来滴定待测溶液,不可选用__(填字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中,眼睛应注视___。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是__mol·L-1,烧碱样品的纯度是___(保留两位数字)。
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(5)下列实验操作会对滴定结果产生什么后果?(填“偏高”“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果___。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果___。
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
温度/℃ | 400 | 500 | 850 |
平衡常数 | 9.94 | 9 | 1 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为___,该反应的Q__0(填“>”或“<”)。
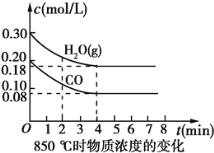
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)浓度变化如图所示,则0~4 min时平均反应速率v(CO)=__。
(3)400℃时,压强恒定的密闭容器中进行上述反应。该可逆反应达到平衡的标志是__(填字母)。
A.v逆(H2)=v正(CO)
B.容器的总体积不再随时间而变化
C.混合气体的密度不再随时间变化
D.CO、H2O、CO2、H2的分子数之比为1∶1∶1∶1
(4)若在500℃时进行,且CO、H2O(g)的起始浓度均为0.020molL-1,该条件下,CO的最大转化率为__。
(5)若在850℃时进行,某时刻时测得CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1mol、0.5mol、0.6mol、0.6mol,此时V正__V逆。(填“>”或“<”或“=”)
(6)若在850℃时进行,设起始时CO和H2O(g)共为1mol,其中水蒸气的体积分数为x,平衡时CO的转化率为y,试推导y随x变化的函数关系式为__。
【题目】工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2:7% O2:11% N2:82%)。
| 0.1个大气压 | 0.5个大气压 | 1个大气压 | 10个大气压 |
400 | 99.2 | 99.6 | 99.7 | 99.9 |
500 | 93.5 | 96.9 | 97.8 | 99.3 |
600 | 73.7 | 85.8 | 89.5 | 96.4 |
(1)SO2的氧化反应是___反应(填“吸热”或“放热”)。
(2)根据图中所给信息,你认为工业上将SO2转化为SO3的适宜条件是___。
(3)选择适宜的催化剂,是否可以提高SO2的转化率?___(填“是”或“否”)。
(4)若保持温度和容积不变,平衡后通入氧气,再达平衡时则SO2浓度___。(填“增大”或“减小”)
(5)若保持温度和压强不变,平衡后通入He气,SO3的含量___。(填“增大”或“减小”)
【题目】硫代硫酸钠(Na2S2O35H2O)俗名“大苏打”,又称为“海波”,易溶于水,难溶于乙醇,加热,遇酸均易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图所示,请回答下列问题。
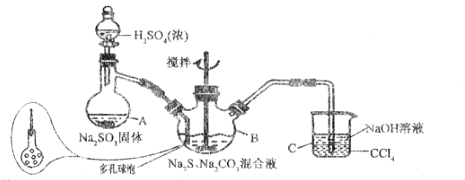
实验具体操作:
Ⅰ.开启分液漏斗,使浓硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,至微沸。
Ⅱ.直至出现的浑浊不再消失,并控制溶液的pH接近7时,停止通SO2气体。
(1)仪器A的名称为______;B中多孔球泡的作用是______;装置C的作用是______。
(2)为了保证硫代硫酸钠的产量,装置B中溶液pH不能小于7,请用离子方程式解释原因______。
(3)为了尽可能得到较纯的Na2S2O3溶液,三颈烧瓶B中Na2S和Na2CO3的物质的量投料比应该为______。
(4)所得产品中常含有硫酸钠杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液等
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③______ | ④有乳黄色沉淀,______ |
⑤静置,取上层清液______ | ⑥______ |
(5)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水配制成100 mL溶液。
②滴定:取0.00950molL-1的K2Cr2O7标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应:Cr2O72-+6I-+14H+═3I2+2Cr3++7H2O.然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32-═S4O62-+2I-.加入淀粉溶液作为指示剂,继续滴定,当溶液______,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为______%(保留1位小数)。