题目内容
【题目】工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2:7% O2:11% N2:82%)。
| 0.1个大气压 | 0.5个大气压 | 1个大气压 | 10个大气压 |
400 | 99.2 | 99.6 | 99.7 | 99.9 |
500 | 93.5 | 96.9 | 97.8 | 99.3 |
600 | 73.7 | 85.8 | 89.5 | 96.4 |
(1)SO2的氧化反应是___反应(填“吸热”或“放热”)。
(2)根据图中所给信息,你认为工业上将SO2转化为SO3的适宜条件是___。
(3)选择适宜的催化剂,是否可以提高SO2的转化率?___(填“是”或“否”)。
(4)若保持温度和容积不变,平衡后通入氧气,再达平衡时则SO2浓度___。(填“增大”或“减小”)
(5)若保持温度和压强不变,平衡后通入He气,SO3的含量___。(填“增大”或“减小”)
【答案】放热 1个大气压、400-500℃(或400℃) 否 减小 减小
【解析】
本题结合了硫酸的工业制取和化学平衡的相关知识,须注意工业流程除了要考虑转化率以外,成本和反应速率也是重要的考量因素,据此来逐项分析即可。
(1)绝大多数的化合反应都是放热的,绝大多数的分解反应都是吸热的,因此二氧化硫的氧化反应是放热的;
(2)先来看温度,400℃到500℃的转化率都比较高,适当提高温度虽然会牺牲一些转化率,但是可以显著提高反应速率;再来看压强,压强越大固然转化率越高,但是10个大气压对设备的要求较高,生产成本也会提升,产生的额外收益却不显著,因此选1个大气压即可;
(3)催化剂不改变平衡常数,因此不提高转化率;
(4)通入氧气相当于提高反应物的浓度,平衡会正向移动,因此二氧化硫的浓度减小;
(5)保持压强不变充入氦气,容器的体积增大,各气体的浓度降低,平衡要向气体分子数增大的方向移动,即逆向移动,因此三氧化硫的含量减小。

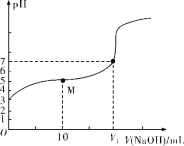
【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液。称量时,样品可放在___(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.2000mol·L-1的盐酸来滴定待测溶液,不可选用__(填字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中,眼睛应注视___。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是__mol·L-1,烧碱样品的纯度是___(保留两位数字)。
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(5)下列实验操作会对滴定结果产生什么后果?(填“偏高”“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果___。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果___。