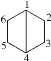
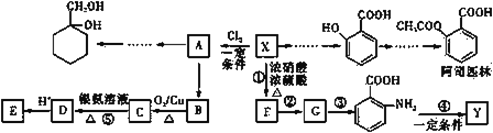
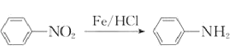
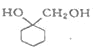
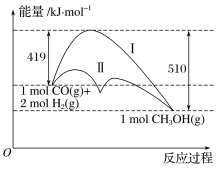
��Ŀ����
����Ŀ����������ƣ�Na2S2O35H2O�����������մ������ֳ�Ϊ����������������ˮ���������Ҵ������ȣ�������ֽ⡣ijʵ����ģ�ҵ���ȡ��������ƣ��䷴Ӧװ�ü������Լ���ͼ��ʾ����ش��������⡣

ʵ����������
������Һ©����ʹŨ�����������£��ʵ����ڷ�Һ©���ĵ��٣�ʹ��Ӧ������SO2����Ͼ��ȵ�ͨ��Na2S��Na2CO3�Ļ����Һ�У�ͬʱ�����綯������������ˮԡ���ȣ����С�
��ֱ�����ֵĻ��Dz�����ʧ����������Һ��pH�ӽ�7ʱ��ֹͣͨSO2���塣
��1������A������Ϊ______��B�ж�����ݵ�������______��װ��C��������______��
��2��Ϊ�˱�֤��������ƵIJ�����װ��B����ҺpH����С��7���������ӷ���ʽ����ԭ��______��
��3��Ϊ�˾����ܵõ��ϴ���Na2S2O3��Һ��������ƿB��Na2S��Na2CO3�����ʵ���Ͷ�ϱ�Ӧ��Ϊ______��
��4�����ò�Ʒ�г��������������ʣ�ѡ�������Լ����ʵ�鷽�����м��飺
�Լ���ϡ���ᡢϡH2SO4��BaCl2��Һ��Na2CO3��Һ��
ʵ�鲽�� | ���� |
��ȡ������Ʒ�������������ˮ | �ڹ�����ȫ�ܽ����ɫ������Һ |
��______ | �������ɫ������______ |
�ݾ��ã�ȡ�ϲ���Һ______ | ��______ |
��5������K2Cr2O7����Һ�����ⶨ��������ƵĴ��ȡ��ⶨ�������£�
����Һ���ƣ���ȡ1.2000gij��������ƾ�����Ʒ��������в���ȴ������ˮ���Ƴ�100 mL��Һ��
�ڵζ���ȡ0.00950molL-1��K2Cr2O7����Һ20.00mL�������ữ��������KI��������Ӧ��Cr2O72-+6I-+14H+�T3I2+2Cr3++7H2O��Ȼ���������������Ʒ��Һ�ζ���������ɫ��������Ӧ��I2+2S2O32-�TS4O62-+2I-�����������Һ��Ϊָʾ���������ζ�������Һ______����Ϊ�յ㡣ƽ�еζ�3�Σ���Ʒ��Һ��ƽ������Ϊ24.80 mL������Ʒ����Ϊ______%������1λС������
���𰸡�������ƿ ������������Һ�ĽӴ�������ӿ췴Ӧ���ʣ��������SO2 ���ն���SO2���������� S2O32����2H��=S����SO2����H2O 2��1 ȡ������������Һ���������ϡ���� �д̼�����ζ���������� ����BaCl2��Һ ������ɫ���� ��ɫ��ȥ���Ұ���Ӳ���ԭ 95.0
��������
װ��A�Ʊ�SO2������Na2SO3��H2SO4(Ũ)=Na2SO4��SO2����H2O��װ��B�Ʊ�Na2S2O3��SO2�ж���Ϊ��ֹ��Ⱦ��������Ҫβ����������װ��C�����������ն����SO2��
(1)�������죬��������A�����ƣ���Ϊ��������Һ��ķ�Ӧ�������Ҫ�������ֱ����սǶȽ��з�����
(2)��������������ֽ���з�����
(3)װ��B�����ķ�Ӧ��4SO2��2Na2S��Na2CO3=CO2��3Na2S2O3��Ȼ����з�����
(4)��Ʒ�л��������ƣ���Ҫ����SO42�����ڣ�����Na2S2O3����ֽ⣬ע��������SO42���Ը�ʵ��ĸ��ţ�
(5)��ʹ��Na2S2O3�ζ�I2��������Һ��ָʾ����������ɫ�仯��
�ڽ�����ϵʽ�����з������㣻
(1)��������A���ص㣬����AΪ������ƿ��B�ж�����ݵ���������SO2��Һ��ĽӴ�������ӿ췴Ӧ���������SO2��SO2�ж�����Ⱦ��������Ҫβ�����գ�װ��C�����������ն���SO2������������
(2)����������Ϣ����������������ֽ⣬��pHС��7ʱ������S2O32����2H��=S����SO2����H2O��
(3)װ��B�з����ķ�Ӧ��4SO2��2Na2S��Na2CO3=CO2��3Na2S2O3����Ҫ���շ�Ӧ����ʽϵ����ֵͶ�룬��ý�Ϊ������Na2S2O3����Na2S��Na2CO3�����ʵ���Ͷ�ϱ�Ϊ2��1��
(4)����Na2SO4����Ҫ����SO42������Ҫ��ȥNa2S2O3��ͬʱ��������SO42���������������ˮ����Ҫ�������ᣬ����S2O32����2H��=S����SO2����H2O�������ɫ���������д̼�����ζ���������ɣ����ú�ȡ�ϲ���Һ������BaCl2��Һ���а�ɫ�������ɣ�
(5)�ٵ������ⵥ�ʱ�������Na2S2O3�ζ��ⵥ�ʣ�������Һ��ָʾ������Һ����ɫ���ζ���������ɫ����ȥ�����ζ��յ���������ɫ��ȥ���Ұ���Ӳ��ָ�ԭ������ɫ��
�ڸ��ݷ�Ӧ��ϵ��������ϵʽCr2O72����3I2��6S2O32������Ʒ��n(S2O32��)=![]() ����Ʒ�Ĵ�����
����Ʒ�Ĵ�����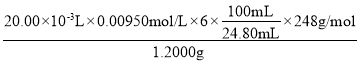 ��100%==95.0%��
��100%==95.0%��