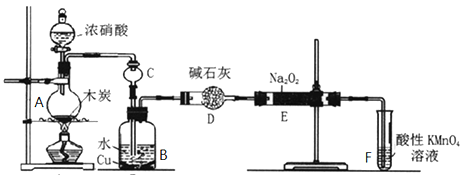
题目内容
【题目】现有常温下甲、乙、丙三种溶液,甲为0.1mol·L-1的NaOH溶液,乙为0.1mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=__。
(2)丙溶液中存在的电离平衡为__(用电离平衡方程式表示)。
(3)常温下,用水稀释0.1mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是__(填序号)。
①n(H+) ②c(H+) ③![]() ④c(OH-)
④c(OH-)
(4)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为___。
(5)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示的两条滴定曲线,则a=__。

【答案】13 CH3COOH![]() CH3COO-+H+,H2O
CH3COO-+H+,H2O![]() OH-+H+ ①④ 丙>甲=乙 20.00
OH-+H+ ①④ 丙>甲=乙 20.00
【解析】
(1)0.1molL-1的NaOH溶液中c(OH-)=0.1mol/L,根据Kw=c(H+)c(OH-)计算溶液中c(H+),再根据pH=-lgc(H+)计算溶液的pH值;
(2)醋酸溶液中存在醋酸分子的电离平衡和水的电离平衡;
(3)酸或碱抑制水电离,含有弱根离子的盐促进水电离;
(4)酸、碱均抑制水的电离,且浓度越大抑制效果越强;
(5)盐酸与氢氧化钠1:1中和时溶液为中性,醋酸与氢氧化钠1:1中和时生成醋酸钠,溶液显碱性。
(1)0.1mol/L的氢氧化钠溶液的pOH为1,则![]() ;
;
(2)醋酸溶液中存在醋酸分子的电离平衡和水的电离平衡:![]() 和
和![]() ;
;
(3)①加水稀释,![]() 和
和![]() 的浓度减小,水的电离平衡正向移动,因此产生更多的
的浓度减小,水的电离平衡正向移动,因此产生更多的![]() ,
,![]() 的物质的量增加,①正确;
的物质的量增加,①正确;
②加水稀释,![]() 的浓度一定会减小,②错误;
的浓度一定会减小,②错误;
③![]() 可以化成
可以化成![]() 的形式,稀释的过程中温度不变,则K值不变,
的形式,稀释的过程中温度不变,则K值不变,![]() 在减小,因此整体是在减小的,③错误;
在减小,因此整体是在减小的,③错误;
④在稀释的过程中,醋酸的酸性减弱,氢离子浓度减小,KW保持不变,![]() 的浓度增大,④正确;
的浓度增大,④正确;
答案选①④;
(4)酸、碱均抑制水的电离,且浓度越大抑制效果越强,甲、乙为浓度相等的一元强酸和一元强碱,因此对水电离的抑制效果是一样的,丙为弱酸,产生的![]() 较少,对水电离的影响也较小,因此水电离出的
较少,对水电离的影响也较小,因此水电离出的![]() 浓度大小为丙>甲=乙;
浓度大小为丙>甲=乙;
(5)盐酸是强酸,氢氧化钠是强碱,当二者1:1中和时溶液为中性,醋酸是弱酸,当二者1:1中和时生成醋酸钠,醋酸钠是弱酸强碱盐显弱碱性;因此a为20.00mL。

 金钥匙试卷系列答案
金钥匙试卷系列答案