题目内容
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
温度/℃ | 400 | 500 | 850 |
平衡常数 | 9.94 | 9 | 1 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为___,该反应的Q__0(填“>”或“<”)。
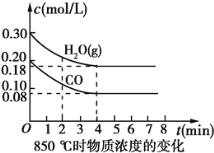
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)浓度变化如图所示,则0~4 min时平均反应速率v(CO)=__。
(3)400℃时,压强恒定的密闭容器中进行上述反应。该可逆反应达到平衡的标志是__(填字母)。
A.v逆(H2)=v正(CO)
B.容器的总体积不再随时间而变化
C.混合气体的密度不再随时间变化
D.CO、H2O、CO2、H2的分子数之比为1∶1∶1∶1
(4)若在500℃时进行,且CO、H2O(g)的起始浓度均为0.020molL-1,该条件下,CO的最大转化率为__。
(5)若在850℃时进行,某时刻时测得CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1mol、0.5mol、0.6mol、0.6mol,此时V正__V逆。(填“>”或“<”或“=”)
(6)若在850℃时进行,设起始时CO和H2O(g)共为1mol,其中水蒸气的体积分数为x,平衡时CO的转化率为y,试推导y随x变化的函数关系式为__。
【答案】K=![]() < 0.03molL-1min-1 A 75% > y=x
< 0.03molL-1min-1 A 75% > y=x
【解析】
(1)首先根据给出的平衡常数可以看出,随着温度的升高平衡常数在减小,说明该反应是一个放热反应;
(2)根据化学反应速率的公式![]() 来列方程即可,注意单位;
来列方程即可,注意单位;
(3)可逆反应达到平衡的标志是各物质的浓度(或者物质的量)不再发生改变,据此来分析选项即可,万变不离其宗;
(4)转化率即![]() ,据此来列方程即可,此处的量可以代入浓度、物质的量、质量等等;
,据此来列方程即可,此处的量可以代入浓度、物质的量、质量等等;
(5)850℃下的平衡常数已知,算出浓度商再和平衡常数进行比较即可;
(6)列出平衡常数的表达式再进行分析。
(1)列出反应的平衡常数表达式:![]() ,随着温度升高平衡常数逐渐减小,说明正反应放热,即
,随着温度升高平衡常数逐渐减小,说明正反应放热,即![]() ;
;
(2)在0~4分钟内,![]() 的浓度变化了0.12mol/L,因此
的浓度变化了0.12mol/L,因此![]() ;
;
(3)A.该项表明正反应速率和逆反应速率相等,即达到平衡状态,A项正确;
B.反应前后气体分子数不变,因此就算是恒压容器,体积也是保持不变的,故不能说明反应达到了平衡状态,B项错误;
C.反应前后气体分子数不变,因此气体密度保持不变,不能说明反应达到了平衡状态,C项错误;
D.分子数为1:1:1:1不能说明反应达到平衡状态,只有各物质的浓度保持不变时才能说明反应达到平衡状态,D项错误;
答案选A;
(4)设反应中生成了x mol/L的![]() ,根据计量比不难看出生成的
,根据计量比不难看出生成的![]() 也为x mol/L,则平衡常数可以表达为
也为x mol/L,则平衡常数可以表达为![]() ,解得
,解得![]() ,转化率
,转化率![]() ,则转化率最大为75%;
,则转化率最大为75%;
(5)假设容器的浓度为1L,求出此时的浓度商:![]() ,而850℃下的平衡常数K为1,
,而850℃下的平衡常数K为1,![]() ,此时尚未达到平衡,反应还将正向进行,因此正反应速率大于逆反应速率;
,此时尚未达到平衡,反应还将正向进行,因此正反应速率大于逆反应速率;
(6)因800℃时反应平衡常数为1,起始时水蒸气的物质的量为x mol,CO的物质的量为![]() ,反应中转化的
,反应中转化的![]() 的物质的量为
的物质的量为![]() ,根据化学计量比不难发现消耗的水蒸气、生成的
,根据化学计量比不难发现消耗的水蒸气、生成的![]() 、生成的
、生成的![]() 均为
均为![]() ,代入平衡常数表达式:
,代入平衡常数表达式:![]() ,化简得出
,化简得出![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】钒(V)为过渡元素,可形成多价态化合物,在工业催化、新材料、新能源等领域有广泛应用。
(1)金属钒熔点很高,可由铝热反应制得。
已知25℃、101 KPa时
4A1(s)+3O2(g)═2Al2O3(s)△H1=akJmol-1
4V(s)+5O2(g)═2V2O5(s)△H2=bkJmol-1
则用铝热反应冶炼金属V(s)的热化学方程式为______。
(2)全钒液流电池是一种新型的绿色环保储能系统,工作原理如图所示:
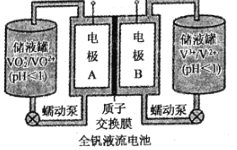
查阅相关资料可知:
离子种类 | VO2+ | VO2+ | V3+ | V2+ |
颜色 | 黄色 | 蓝色 | 绿色 | 紫色 |
①该电池放电时,VO2+发生还原反应,则正极的反应式是______。
②当完成储能时,负极溶液的颜色为______。
③电池放电时,负极区溶液的pH将______(填“增大”、“减小”或“不变”)。
④用该钒电池在铁制品上镀铜,铁制品应与电池的______极(填“A“或“B“)相连。若电镀开始时两电极质量相等,电镀一段时间后,两电极质量之差为128g,此时转移电子的物质的量为______。
【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积Kw | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a__1×10-14(填“>”“<”或“=”)。
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1 mL加水稀释至10mL,则稀释后溶液中c(Na+)∶c(OH-)=__。
(3)在t2℃下pH=10的NaOH溶液中,水电离产生的OH-浓度c(OH-)水=__。
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__。