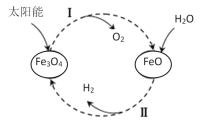
题目内容
【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积Kw | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a__1×10-14(填“>”“<”或“=”)。
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1 mL加水稀释至10mL,则稀释后溶液中c(Na+)∶c(OH-)=__。
(3)在t2℃下pH=10的NaOH溶液中,水电离产生的OH-浓度c(OH-)水=__。
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__。
【答案】> 1000∶1 10-10mol·L-1 9∶11
【解析】
(1)电离为吸热过程,根据“越热越电离”的规律进行分析;
(2)注意中性溶液中,![]() 的浓度为
的浓度为![]() ,而硫酸根离子浓度醉着溶液体积的增大而减小。
,而硫酸根离子浓度醉着溶液体积的增大而减小。
(3)酸、碱均抑制水的电离,溶液中水电离产生的![]() 和
和![]() 的浓度均小于
的浓度均小于![]() ;
;
(4)混合后的溶液为酸性,所以![]() 过量,根据酸碱中和规律进行计算。
过量,根据酸碱中和规律进行计算。
(1)根据“越热越电离”的规律,a必定大于25℃下的离子积;
(2)硫酸钠中![]() 和
和![]() 是2:1的关系,溶液体积稀释到10倍,浓度会变为十分之一,因此稀释后
是2:1的关系,溶液体积稀释到10倍,浓度会变为十分之一,因此稀释后![]() 的浓度为
的浓度为![]() =10-4mol/,而中性溶液中
=10-4mol/,而中性溶液中![]() 的浓度为
的浓度为![]() ,二者为1000:1的关系;
,二者为1000:1的关系;
(3)酸、碱均抑制水的电离,所以先求出溶液中的![]() 和
和![]() 的浓度,谁小于
的浓度,谁小于![]() 谁就是水电离出来的,题目告知了
谁就是水电离出来的,题目告知了![]() 为
为![]() ,则水电离出的
,则水电离出的![]() 也为
也为![]() ;
;
(4)混合后的溶液为酸性,所以![]() 过量,首先根据pH不难算出硫酸中
过量,首先根据pH不难算出硫酸中![]() 为
为![]() ,
,![]() 溶液中
溶液中![]() 为
为![]() ,二者中和后剩余的
,二者中和后剩余的![]() 为
为![]() ,根据
,根据![]() 解得
解得![]() 。
。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
温度/℃ | 400 | 500 | 850 |
平衡常数 | 9.94 | 9 | 1 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为___,该反应的Q__0(填“>”或“<”)。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)浓度变化如图所示,则0~4 min时平均反应速率v(CO)=__。

(3)400℃时,压强恒定的密闭容器中进行上述反应。该可逆反应达到平衡的标志是__(填字母)。
A.v逆(H2)=v正(CO)
B.容器的总体积不再随时间而变化
C.混合气体的密度不再随时间变化
D.CO、H2O、CO2、H2的分子数之比为1∶1∶1∶1
(4)若在500℃时进行,且CO、H2O(g)的起始浓度均为0.020molL-1,该条件下,CO的最大转化率为__。
(5)若在850℃时进行,某时刻时测得CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1mol、0.5mol、0.6mol、0.6mol,此时V正__V逆。(填“>”或“<”或“=”)
(6)若在850℃时进行,设起始时CO和H2O(g)共为1mol,其中水蒸气的体积分数为x,平衡时CO的转化率为y,试推导y随x变化的函数关系式为__。