题目内容
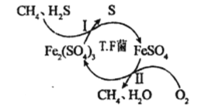
【题目】氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用。砷(As)位于周期表中的第4周期,与氮元素属同一主族元素,其广泛分布于自然界。试回答下列问题:
(1)砷的气态氢化物的电子式为___________,其稳定性比NH3_______(填“强”或“弱”)。
(2)NA表示阿伏加德罗常数的数值。46gNO2和N2O4的混合气体中含有____NA个氮原子;分子总数为NA个的NO2和CO2混合气体含______ NA个氧原子数;1mol15N中,中子数比质子数多_______ NA个;1L 1mol/LFe(NO3)3溶液中含_____NA个NO3-离子。
(3)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式_________________________。
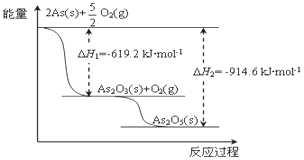
(4)砷的常见酸性氧化物有As2O3和As2O5,请根据图相关信息写出As2O5分解为As2O3的热化学方程式_______________________________________。
(5)直接供氨式碱性燃料电池的电池反应式是4NH3 + 3O2 = 2N2 + 6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是________________________________。
【答案】![]() 弱 1 2 1 3 NaClO+2NH3=N2H4+NaCl+H2O As2O5(s) = As2O3(s) + O2(g) ; H= +295.4 kJ·mol-1 2NH3 + 6OH-—6e-=N2+6H2O
弱 1 2 1 3 NaClO+2NH3=N2H4+NaCl+H2O As2O5(s) = As2O3(s) + O2(g) ; H= +295.4 kJ·mol-1 2NH3 + 6OH-—6e-=N2+6H2O
【解析】
(1)砷与N同主族,根据元素周期律分析解答;
(2)根据n=![]() =
=![]() 结合分子的构成计算,Fe(NO3)3溶液中,c(NO3-)=3c[Fe(NO3)3],据此分析解答;
结合分子的构成计算,Fe(NO3)3溶液中,c(NO3-)=3c[Fe(NO3)3],据此分析解答;
(3)次氯酸钠与氨气反应,NaClO为氧化剂,NH3为还原剂,据此书写反应的方程式;
(4)由图象可知As2O3生成As2O5的反应热为(-914.6kJ/mol+619.2kJ/mol)=-295.4kJ/mol,以此可计算As2O5分解为As2O3的反应热;
(5)根据总反应,碱性条件下,氨气被氧化生成N2和水,据此分析书写电极反应式。
(1)砷的气态氢化物为AsH3,结构类似于氨气,电子式为![]() ,非金属性As<N,元素的非金属性越强,对应的氢化物越稳定,则稳定性比NH3弱,故答案为:
,非金属性As<N,元素的非金属性越强,对应的氢化物越稳定,则稳定性比NH3弱,故答案为:![]() ;弱;
;弱;
(2)NO2和N2O4的最简式都为NO2,则46gNO2和N2O4的混合气体中含有![]() =1molN原子,则N原子个数为NA;NO2和CO2的分子组成相似,则分子总数为NA个的NO2和CO2混合气体含2NA个氧原子数;15N中质子数为7,中子数为15-7=8,则1mol15N中,中子数比质子数多NA个,1mol/LFe(NO3)3溶液中,c(NO3-)=3mol/L,1L溶液中含有3molNO3-,即含3NA个NO3-离子,故答案为:1;2;1;3;
=1molN原子,则N原子个数为NA;NO2和CO2的分子组成相似,则分子总数为NA个的NO2和CO2混合气体含2NA个氧原子数;15N中质子数为7,中子数为15-7=8,则1mol15N中,中子数比质子数多NA个,1mol/LFe(NO3)3溶液中,c(NO3-)=3mol/L,1L溶液中含有3molNO3-,即含3NA个NO3-离子,故答案为:1;2;1;3;
(3)制备联氨可用丙酮为催化剂,以NaClO氧化NH3,反应中还原剂与氧化剂的物质的量之比为2∶1,反应的化学方程式为NaClO+2NH3═N2H4+H2O+NaCl,故答案为:NaClO+2NH3=N2H4+NaCl+H2O;
(4)由图象可知As2O3生成As2O5的反应热为(-914.6kJ/mol+619.2kJ/mol)=-295.4kJ/mol,则As2O5分解为As2O3的反应热为+295.4kJ/mol,所以热化学方程式为As2O5(s)=As2O3(s)+O2(g) △H=+295.4 kJmol-1,故答案为:As2O5(s)=As2O3(s)+O2(g) △H=+295.4 kJmol-1;
(5)根据电池反应4NH3 + 3O2 = 2N2 + 6H2O可知,氨气被氧化,在负极发生氧化反应,碱性条件下,氨气被氧化生成N2和水,电极反应式为2NH3+6OH--6e-=N2+6H2O,故答案为:2NH3+6OH--6e-=N2+6H2O。

【题目】用中和滴定法测定某烧碱的纯度。将2.5g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成250mL溶液。根据实验回答下列问题:
I.滴定前的准备
检漏→用蒸馏水清洗→用待装溶液润洗→装液→①→调节液而在“0”刻度或“0”刻度以下→记录初始读数
II.滴定
分别取20.00mL待测液于3个洁净的锥形瓶中,滴加2滴酚酞试液,然后用0.2000mol·L-1盐酸标准液进行滴定至终点,记录最终读数。数据如下:
滴定序号 | 待测液体积(mL) | 滴定前(mL) | 滴定后(mL) |
1 | 20.00 | 0.50 | 20.70 |
2 | 20.00 | 6.00 | 26.00 |
3 | 20.00 | 5.00 | 25.10 |
III.实验数据处理
(1)将步骤I中的操作补充完整:
①___________
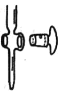
(2)如图所示为___________ (填“酸式”或“碱式”)滴定管的一部分,若该滴定管漏水或转动不灵活,可采取的措施是___________
(3)滴定终点的现象是_______
(4)计算:NaOH溶液的浓度为_______mol·L-1烧碱样品的纯度为________
(5)试判断以下几种情况对烧碱纯度测定结果的影响(填“偏大”、“偏小”或“无影响”)
①若用蒸馏水冲洗锥形瓶,使测定结果_____________
②若滴定前滴定管尖嘴有气泡,滴定后气泡消失,使测定结果_____________
③若刚见到指示剂局部的颜色有变化就停止滴定,使测定结果_____________
④读数时,若滴定前仰视,滴定后俯视,使测定结果_____________