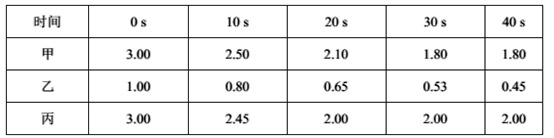
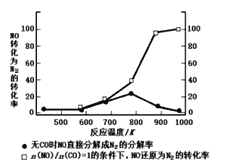
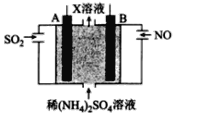
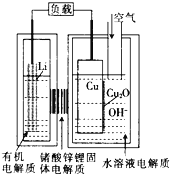
0 202468 202476 202482 202486 202492 202494 202498 202504 202506 202512 202518 202522 202524 202528 202534 202536 202542 202546 202548 202552 202554 202558 202560 202562 202563 202564 202566 202567 202568 202570 202572 202576 202578 202582 202584 202588 202594 202596 202602 202606 202608 202612 202618 202624 202626 202632 202636 202638 202644 202648 202654 202662 203614