��Ŀ����
����Ŀ���������ƣ�NaNO2����һ������Ʒ�����г�����ʳƷ���Ӽ���ʹ��ʱ�����ϸ��������������Ư�ס���Ƶȷ���Ӧ��Ҳ�ܹ㷺��ij��ȤС�����������ͼ��ʾ��װ���Ʊ�NaNO2��A�м���װ������ȥ����
��֪�������£���2NO+Na2O2===2NaNO2
�����������£�NO ��NO2-������MnO4-��Ӧ����NO3-��Mn2+
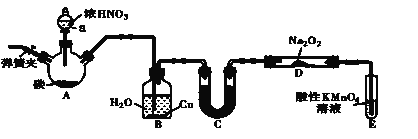
��1��A�з�����Ӧ�Ļ�ѧ����ʽΪ_________________________________��
��2��������װ�õ������ԣ�װ��ҩƷ��ʵ�鿪ʼǰͨ��һ��ʱ��N2��Ȼ��رյ��ɼУ��ٵμ�Ũ���ᣬ���ȡ�ͨ��N 2��������______________��
��3��װ��B�й۲쵽����Ҫ����Ϊ_________________
��4����Ϊ��֤�Ƶõ��������ƵĴ��ȣ�Cװ����ʢ�ŵ��Լ�������___________������ĸ��ţ���
A��P2O5 B����ˮCaCl2 C����ʯ�� D��Ũ����
�����ȡ��Cװ�ã�D�й�������NaNO2�⣬���ܺ��еĸ�������________ д��ѧʽ����
��5��E�з�����Ӧ�����ӷ���ʽΪ____________��
��6����1.56g Na2O2��ȫת��ΪNaNO2��������������Ҫľ̿__________g��
���𰸡�C+4HNO3(Ũ)![]() CO2��+4NO2��+2H2O �ž���������ֹ���ɵ�NO���������� ����ɫ������ʧ��ͭƬ�ܽ⣬��Һ���������ܿ�����ɫ����ð�� C Na2CO3��NaOH 5NO+3MnO4+4H+=5NO3+3 Mn2++2H2O 0.24g
CO2��+4NO2��+2H2O �ž���������ֹ���ɵ�NO���������� ����ɫ������ʧ��ͭƬ�ܽ⣬��Һ���������ܿ�����ɫ����ð�� C Na2CO3��NaOH 5NO+3MnO4+4H+=5NO3+3 Mn2++2H2O 0.24g
��������
Aװ��ΪC��HNO3 (Ũ)��Ӧ���ɶ�����̼���������������������B����ˮ��Ӧ�������ᣬ������Cu��Ӧ����NO�� Dװ�����Ʊ�NaNO2�����ڶ�����̼��ˮ������������Ʒ�Ӧ�ĵõ�̼���ơ��������ƣ�����Ҫ��ȥ������̼��������NO���壬����C�з��˼�ʯ�ң���Ӧ��ʼ��Ҫ�ž�װ���еĿ�������ֹ������NO�������������Ը��������Һ��Һ����δ��Ӧ��NO�����Է�ֹ��Ⱦ������
(1)Aװ��ΪC��HNO3 (Ũ)��Ӧ���ɶ�����̼�������������Ӧ����ʽΪ��C+4HNO3(Ũ)![]() CO2��+4NO2��+2H2O��
CO2��+4NO2��+2H2O��
(2)ʵ�鿪ʼǰͨ��һ��ʱ��N2�����ž�װ���еĿ�������ֹ������NO������
(3)����������B����ˮ��Ӧ�������ᣬ������Cu��Ӧ����NO�����Կ���������Ϊ������ɫ������ʧ��ͭƬ�ܽ⣬��Һ���������ܿ�����ɫ����ð����
(4)�ٸ��ݷ�����֪��Cװ���п���ʢ�ŵ��Լ��Ǽ�ʯ�ң�
�ڽ�Ϸ�����֪��������̼��ˮ������������Ʒ�Ӧ�ĵõ�������̼���ơ��������ƣ�
(5)������Ŀ�ṩ��Ϣ��֪���������£�NO����MnO4��Ӧ����NO3��Mn2+������ʽΪ��5NO+3MnO4+4H+=5NO3+3 Mn2++2H2O��
(6)n(Na2O2)=![]() =0.02mol������Ԫ���غ��֪1.56g Na2O2��ȫת��ΪNaNO2����Ҫn(NO)=0.04mol����μӷ�Ӧ��̼Ϊx mol�����ݷ���ʽC+4HNO3(Ũ)
=0.02mol������Ԫ���غ��֪1.56g Na2O2��ȫת��ΪNaNO2����Ҫn(NO)=0.04mol����μӷ�Ӧ��̼Ϊx mol�����ݷ���ʽC+4HNO3(Ũ)![]() CO2��+4NO2��+2H2O��֪����n(NO2)=4x mol�����ݷ���ʽ3 NO2+H2O=2HNO3+ NO����֪4x mol NO2��ˮ��Ӧ����
CO2��+4NO2��+2H2O��֪����n(NO2)=4x mol�����ݷ���ʽ3 NO2+H2O=2HNO3+ NO����֪4x mol NO2��ˮ��Ӧ����![]() x mol�����
x mol�����![]() x molNO������3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O��֪������ͭ��Ӧ���ɵ�NOΪ
x molNO������3Cu+8HNO3=3Cu(NO3)2+2NO+4H2O��֪������ͭ��Ӧ���ɵ�NOΪ![]() x mol��������
x mol��������![]() x mol+
x mol+![]() x mol=2x mol=0.04mol�����x=0.02mol������Ҫ��̼������Ϊ12g/mol��0.02mol=0.24g��
x mol=2x mol=0.04mol�����x=0.02mol������Ҫ��̼������Ϊ12g/mol��0.02mol=0.24g��

 �п������п��Ծ����ϵ�д�
�п������п��Ծ����ϵ�д� ��������״Ԫ��ϵ�д�
��������״Ԫ��ϵ�д�����Ŀ��ij̼�ظֹ�¯��ˮ������Ҫ�ɷ���̼��ơ�����ơ�������þ�����⡢��������ȡ� ˮ�����γɰ�ȫ�������輰ʱ��ϴ��ȥ����ϴ�������£�
����NaOH��Na2CO3���Һ�����ȣ�������Сʱ��
�ų�ϴ�ӷ�Һ����ˮ��ϴ��¯������ϡ���ᣬ���ݣ�
����ϴҺ�м���Na2SO3��Һ��
������ϴ��꣬��NaNO2��Һ�ۻ���¯��
(1)��NaOH�ܽ��������Ļ�ѧ����ʽ��_________________________��
(2)��֪��20��ʱ�ܽ��/g
CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
1.4��10-3 | 2.55��10-2 | 9��10-4 | 1.1��10-2 |
������м���Na2CO3�ɳ�ȥˮ���е�______________________��
(3)�ڲ�����У�
�ٱ�������ˮ���������⣬����____________________________��
����ϴ�����У��ܽ���������ٹ�¯��ʴ�������ӷ���ʽ������ԭ��__________________��
(4)������У�����Na2SO3��Ŀ����______________________����������ӷ���ʽ�����ֱ��
(5)������У��ۻ���Ĺ�¯����Ḳ��һ�����ܵ�Fe3O4����Ĥ��
����ɲ���ƽ�䷴Ӧ�����ӷ���ʽ��
____Fe+____NO2-+____H2O=______N2��+__________+_______��
�������16.8 g�����ۻ�,��ת�Ƶĵ�����Ϊ___________________(������λ��Ч����)��
����Ŀ�����־��и�ǿ�ȡ�������������ĥ�𡢿���������ܣ������������ͷɻ����졣һ�ִ�ʯú����SiO2��V2O3��V2O5������Fe2O3������ȡV2O5����������ͼ��ʾ��
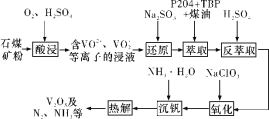
��֪��
VO2�� | VO2+ | Fe2�� | Fe3�� | |
P2O4��TBP��ú���е��ܽ�� | �ܴ� | ��С | 0 | �ܴ� |
��ش��������⣺
��1���������ʱ��Ϊ��߽������ʣ����ʵ���������Ũ�ȡ���Сʯú��������⣬���ɲ�ȡ�Ĵ�ʩ��__________����дһ����������VO2����Ӧ�����ӷ���ʽΪ_______��
��2����������������������ԭ����Ŀ��Ϊ_______��
��3��ʵ����ģ������ȡ��ʱ�����õ��IJ���������____________��
��4����������ʱ������Ӧ�����ӷ���ʽΪ__________��
��5�����������п���ѭ�����õ�������_________��
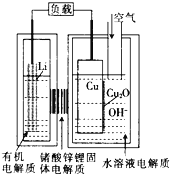
��6��ȫ��Һ�����ܵ�صĹ���ԭ��ΪVO2����V3����H2O![]() VO2+��V2����2H����
VO2+��V2����2H����
�ٳ��ʱ�������ĵ缫��ӦʽΪ______��
�������������ӽ���Ĥ�������ŵ�ʱ�������·ת��2mole��������������Һ��n��H����________������������������������________mol��