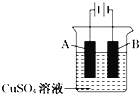
题目内容
【题目】a、b、c、d、e是元素周期表中前四周期的元素,其原子序数依次增大,a为元素周期表中原子半径最小的元素,b的基态原子中占有电子的3个能级上的电子总数均相等,d与b同族,c与b同周期,且c的所有p轨道上的电子总数与所有s轨道上的电子总数相等,e的次外层电子数是其最外层电子的7倍。回答下列问题:
(1)c、d形成的化合物的晶体类型为___________;
(2)b、a c形成的三原子分子中,c原子的杂化方式为___________;
(3)b、c、d三种元素的电负性由小到大的顺序为___________;(用元素符号表示),d元素基态原子价层电子排布式为_________;
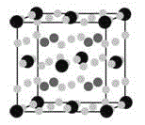
(4)金属Mg与a、e形成的化合物是目前人类已发现的体积储氢密度最高的储氢材料之一,其晶胞结构如图所示,其中黑球代表e,深灰色小球代表Mg,浅灰色小球代表a,其中浅灰色小球除在棱上、面上以外,在晶胞内部还有6个。试写出该化合物的化学式:__________________。
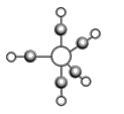
(5)b、c、e能形成如图所示三角双锥构型的配合物分子,三种元素的原子分别用大白球、小白球和灰色小球代表。该配合物形成配位键时提供空轨道的原子是___________(填元素符号),该配合物中大白球代表的元素的化合价为___________。
(6)①在水溶液中,水以多种微粒的形式与其他化合物形成水合物。试画出如下微粒的结构图式。H5O2+______________________
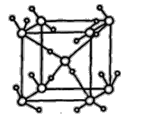
②如图为冰的一种骨架形式,依此为单位向空间延伸该冰中的每个水分子有___________个氢键;如果不考虑晶体和键的类型,哪一物质的空间连接方式与这种冰的连接类似_______
【答案】原子晶体 sp3 Si<C<O 3s23p2 Mg2FeH6 Fe 0  2 SiO2
2 SiO2
【解析】
a为元素周期表中原子半径最小的元素则a是H元素,b的基态原子中占有电子的3个能级上的电子数均相等,则b是C元素,d与b同族即d是Si元素,c与b同周期即C元素为与第二周期,且c的所有p轨道上的电子数与所有s轨道上的电子数相等,则c的基态原子核外电子排布为: 1s2s2p4即c 是O元素, E的次外层电子数是其最外层电子的7倍则e的基态原子核外电子排布为: 1s22s22p63s23p63d64s2, 所以e是Fe元素。
(1)c是 O元素,d是Si元素,形成化合物SiO2, SiO2属于原子晶体;
(2)a是H元素,c是O元素,它们形成的三原子分子是H2O,中心原子价层电子对数为![]() =4,孤电子对数为2,空间构型为V形,杂化方为sp3杂化;
=4,孤电子对数为2,空间构型为V形,杂化方为sp3杂化;
(3)同一周期,从左到右元素电负性递增,同一主族,自上而下元素电负性递减,即电负性:
Si<C<O;d是Si元素,它的基态原子核外电子排布式为: 1s2s2p63s23p2, 即它的基态原子价层电子排布式为: 3s23p2;
(4)8个Mg原子在晶胞内部,黑球为Fe原子,一个晶胞中含有的Fe原子数为![]() ,a为H原子,一个晶胞中含有的H原子数为
,a为H原子,一个晶胞中含有的H原子数为![]() =24,Mg:Fe:H=2:1:6,故其分子式为Mg2FeH6;
=24,Mg:Fe:H=2:1:6,故其分子式为Mg2FeH6;
(5)三角双锥构型为对称性结构,因此该分子为非极性分子,对比三种球的原子半径大小可知小白球为O原子,灰色小球为C原子,大白球为Fe原子,Fe原子具有多余的原子轨道,可提供空轨道,形成化合物Fe(CO)5,其中Fe(CO)5中Fe的化合价为0;
(6)①H5O2+可以写成两个水分子以氢键相连,其中一个水分子的O再以氢键连结一个氢离子,书写时将所有原子看为一个整体用方括号括起来,“+”放在方括号右上角,即结构为 ;
;
②晶体冰中,每两个水分子间有一个氢键,平均属于每个水分子有0.5个,一个水分子与周围的四个水分子以氢键结合,故1mol冰中有2mol氢键;二氧化硅是原子晶体,Si-O通过共价键形成四面体结构,四面体之间通过共价键形成空间网状结构,以立方体中的水分子为研究对象,每个水分子形成4条氢键,SiO2空间连接方式与这种冰连接类似。