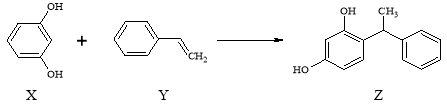
题目内容
【题目】设阿伏加德罗常数的数值为NA,下列说法正确的是
A.1L 1 mol·L-1 的NaHCO3溶液中含有的离子数为3NA
B.22.4 L的CO2与过量Na2O2充分反应转移的电子数为NA
C.常温下,2.7 g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
D.常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA
【答案】D
【解析】
A.HCO3-不能完全电离,部分发生水解,因此1L、1 mol·L-1的NaHCO3溶液中含有的离子数小于3NA,故A错误;
B.未注明气体的状况,无法确定气体的物质的量,故B错误;
C.铝片遇到冷的浓硫酸会钝化,铝失去的电子数小于0.3NA,故C错误;
D.氮气和一氧化碳的摩尔质量都是28g/mol,都是双原子分子,14g由N2与CO组成的混合气体的物质的量为:![]() =0.5mol,含有1mol原子,含有的原子数目为NA,故D正确;
=0.5mol,含有1mol原子,含有的原子数目为NA,故D正确;
故答案为D。

【题目】某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。 水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是_________________________。
(2)已知:20℃时溶解度/g
CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
则步骤Ⅰ中加入Na2CO3可除去水垢中的______________________。
(3)在步骤Ⅱ中:
①被除掉的水垢除铁锈外,还有____________________________。
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因__________________。
(4)步骤Ⅲ中,加入Na2SO3的目的是______________________。(结合离子方程式用文字表达)
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜。
①完成并配平其反应的离子方程式:
____Fe+____NO2-+____H2O=______N2↑+__________+_______。
②如果有16.8 g铁被钝化,则转移的电子数为___________________(保留三位有效数字)。