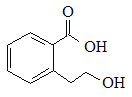
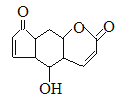
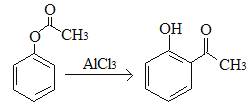题目内容
【题目】在10mL pH=4的盐酸中加水,稀释到100mL时,溶液pH为______;若加水稀释到1000mL时,溶液pH为________;若加水稀释到10000L时,溶液pH________
【答案】5 6 接近7并小于7
【解析】
pH=-lgc(H+),根据氢离子的物质的量相等计算稀释后溶液中氢离子浓度,再计算溶液的pH。
盐酸是一元强酸,10mLpH=4的盐酸,稀释10倍到100mL时,溶液体积增大10倍,则氢离子浓度减小为原来的![]() ,所以其pH增大1,溶液pH为5,加水稀释到1000mL时,溶液体积增大100倍,则氢离子浓度减小为原来的
,所以其pH增大1,溶液pH为5,加水稀释到1000mL时,溶液体积增大100倍,则氢离子浓度减小为原来的![]() ,所以其pH增大2,溶液pH为6,稀释104倍到10000L时,氢离子的浓度更小,仍然为酸溶液,但溶液接近中性,则c(H+)≈107mol/L,溶液pH接近7并小于7。
,所以其pH增大2,溶液pH为6,稀释104倍到10000L时,氢离子的浓度更小,仍然为酸溶液,但溶液接近中性,则c(H+)≈107mol/L,溶液pH接近7并小于7。

【题目】乙炔加氢是乙烯工业中的重要精制反应,利用这一反应可以将乙烯产品中的乙炔含量降低,以避免后续乙烯聚合催化剂的中毒,工业上称为碳二加氢过程。
已知:I. ![]()
![]() ;
;
II. ![]()
![]() ;
;
回答下列问题:
(1)已知几种化学键的键能如表所示:
化学键 |
|
|
|
|
键能/ | 436 | 413.4 | 615 | 812 |
![]() =____________
=____________![]() 。
。
(2)400K时,在密闭容器中将等物质的量的![]() 和
和![]() 混合,采用适当的催化剂进行反应,生成
混合,采用适当的催化剂进行反应,生成![]() ,达到平衡时测得
,达到平衡时测得![]() ,则平衡时
,则平衡时![]() _____
_____![]() 。
。
(3)据前人研究发现乙炔在![]() 团簇表面催化加氢反应的部分历程如图所示,其中吸附在
团簇表面催化加氢反应的部分历程如图所示,其中吸附在![]() 表面上的物种用*标注。
表面上的物种用*标注。

推测乙烯在![]() 表面上的吸附为__________(填“放热”或“吸热”)过程。图中历程中最大能垒(活化能)E正=______
表面上的吸附为__________(填“放热”或“吸热”)过程。图中历程中最大能垒(活化能)E正=______![]() ,该步骤的化学方程式为___________。
,该步骤的化学方程式为___________。
(4)![]() 时,将体积比为1:2的
时,将体积比为1:2的![]() 和
和![]() 充入刚性密闭容器中,加入催化剂发生反应Ⅱ,起始体系总压强为
充入刚性密闭容器中,加入催化剂发生反应Ⅱ,起始体系总压强为![]() ,实验测得
,实验测得![]() 的分压
的分压![]() 与反应时间
与反应时间![]() 的关系如图所示:
的关系如图所示:
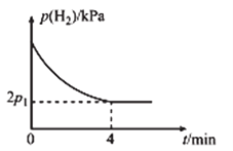
①![]() 时,
时,![]() 内,平均反应速率
内,平均反应速率![]() ______
______![]() (用含
(用含![]() 的代数式表示,下同)。
的代数式表示,下同)。
②![]() 时,该反应的化学平衡常数
时,该反应的化学平衡常数![]() _____
_____![]() (
(![]() 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
③![]() 时,
时,![]() 内,
内,![]() 的减小量______(填“>”“<”或“=”)
的减小量______(填“>”“<”或“=”) ![]() 内
内![]() 的减小量,理由为__________。
的减小量,理由为__________。