【题目】下列表格中的各种情况,可以用对应选项中的图像表示的是
选项 | 反应 | 甲 | 乙 |
A | 外形、大小相近的金属和水反应 | Na | K |
B | 4mL0.01mol·L-1 KMnO4溶液分别和不同浓度的2mLH2C2O4(草酸)溶液反应 | 0.1mol·L-1的H2C2O4溶液 | 0.2mol·L-1的H2C2O4溶液 |
C | 5mL0.1mol·L-1Na2S2O3溶液和5mL0.1mol·L-1H2SO4溶液反应 | 热水 | 冷水 |
D | 5mL4%的过氧化氢溶液分解放出O2 | 无MnO2粉末 | 加MnO2粉末 |
A.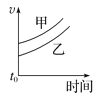 B.
B.
C. D.
D.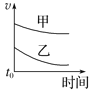
【题目】某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色。通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下。
编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3溶液/mL | H2O/mL | 反应温度/°C | 溶液变蓝所用时间t/s |
① | 6.0 | 10.0 | 4.0 | 15 | t1 |
② | 6.0 | 14.0 | 0 | 15 | t2 |
③ | 6.0 | a | b | 25 | t3 |
(1)实验①②是探究_______________对反应速率的影响,表中t1_________t2(填“>”、“=”或“<”);实验①③是探究温度对反应速率的影响,表中a=_________,b=_________。
(2)改变反应温度,重复实验③,得到溶液变蓝所需时间(t)与温度(T)的关系如图所示(超过50°C后溶液不会再变蓝)。a、b、c、d四点中,反应速率最快的是_________。(填选项)
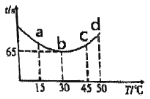
A.a点 B.b点 C.c点 D.d点
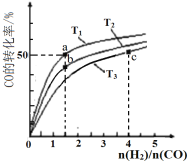
【题目】研究与深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁。高炉炼铁过程中发生的主要反应为:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
温度/°C | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
则该反应的平街常数表达式K=_________,H_________0(填“>”、“<”或“=”)。
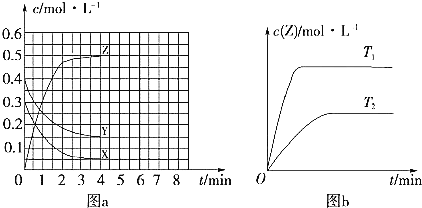
(2)CO2可用于生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),为探究该反应原理,将1 mol CO2和3 mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应,测得甲醇的物质的量随时间的变化如下图所示。
CH3OH(g)+H2O(g),为探究该反应原理,将1 mol CO2和3 mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应,测得甲醇的物质的量随时间的变化如下图所示。
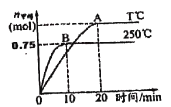
请分析并回答下列问题:
250°C时,反应在前10min的平均速率v(H2)_________molL-1min-1,从反应开始到平衡,CO2转化率为_________%。相同温度下,若某时刻该容器中含有1 mol H2、1.2mol CO2、0.8mol CH3OH、1.5 mol H2O,则此时反应所处的状态为____________________________________(填“向正反应方向进行中”、“向逆反应方向进行中心”或“平衡状态”)。
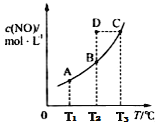
【题目】800°C时,在2L密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g) H<0,测得n(NO)随时间的变化如下表:
2NO2(g) H<0,测得n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)NO的平衡浓度c(NO)=____________________。
(2)下图中表示NO2的变化的曲线______________。(填字母)
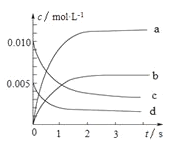
(3)能说明该反应已经达到化学平衡状态的是______________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=v正(O2) D.容器内NO、O2、NO2同时存在
(4)下列操作中,能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
A.及时分离出NO2气体B.适当升高温度
C.增大O2的浓度D.选择高效的催化剂
(5)下图中的曲线表示的是其它条件一定时,体系中NO的平衡转化率与温度的关系。图中标有a、b、c、d四点,其中表示v(正)<v(逆)的点是____________。(填选项)
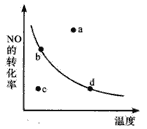
A.a B.b C.c D.d
【题目】请依据化学知识回答下列问题:
(1)实验测得0.16g CH4完全燃烧生成224mLCO2(标准状况)和0.36g液态水,并放出8.903kJ的热量。则CH4的燃烧热为________kJmol-1。
(2)碳酸锰热解制二氧化锰分两步进行:
i.MnCO3(s)![]() MnO(s)+CO2(g) H1=+a kJmol-1
MnO(s)+CO2(g) H1=+a kJmol-1
ii.2MnO (s)+ O2(g)![]() 2MnO2(s) H2=+b kJmol-1
2MnO2(s) H2=+b kJmol-1
请写出焙烧MnCO3制取MnO2的热化学方程式:______________________________________。
(3)下面是某同学探究可逆反应2NO2(g)![]() N2O4(g) H=-56.9 kJmol-1的部分实验报告,据此回答问题。
N2O4(g) H=-56.9 kJmol-1的部分实验报告,据此回答问题。

甲烧杯中NO2球的红棕色变浅。说明平衡2NO2(g)![]() N2O4(g)向________(填“正反应”或“逆反应”)方向移动,所以NH4NO3晶体溶于水是________(填“放热”或“吸热”)过程。
N2O4(g)向________(填“正反应”或“逆反应”)方向移动,所以NH4NO3晶体溶于水是________(填“放热”或“吸热”)过程。
(4)25°C时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请依此判断CH3COOH、H2CO3、HClO的酸性由强到弱的顺序是________________________