题目内容
【题目】请依据化学知识回答下列问题:
(1)实验测得0.16g CH4完全燃烧生成224mLCO2(标准状况)和0.36g液态水,并放出8.903kJ的热量。则CH4的燃烧热为________kJmol-1。
(2)碳酸锰热解制二氧化锰分两步进行:
i.MnCO3(s)![]() MnO(s)+CO2(g) H1=+a kJmol-1
MnO(s)+CO2(g) H1=+a kJmol-1
ii.2MnO (s)+ O2(g)![]() 2MnO2(s) H2=+b kJmol-1
2MnO2(s) H2=+b kJmol-1
请写出焙烧MnCO3制取MnO2的热化学方程式:______________________________________。
(3)下面是某同学探究可逆反应2NO2(g)![]() N2O4(g) H=-56.9 kJmol-1的部分实验报告,据此回答问题。
N2O4(g) H=-56.9 kJmol-1的部分实验报告,据此回答问题。

甲烧杯中NO2球的红棕色变浅。说明平衡2NO2(g)![]() N2O4(g)向________(填“正反应”或“逆反应”)方向移动,所以NH4NO3晶体溶于水是________(填“放热”或“吸热”)过程。
N2O4(g)向________(填“正反应”或“逆反应”)方向移动,所以NH4NO3晶体溶于水是________(填“放热”或“吸热”)过程。
(4)25°C时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请依此判断CH3COOH、H2CO3、HClO的酸性由强到弱的顺序是________________________
【答案】890.3 2MnCO3(s)+ O2(g)![]() 2MnO2(s) +CO2(g) H=+(2a+b) kJmol-1 正反应 吸热 CH3COOH>H2CO3>HClO
2MnO2(s) +CO2(g) H=+(2a+b) kJmol-1 正反应 吸热 CH3COOH>H2CO3>HClO
【解析】
(1)根据燃烧热为1mol可燃物完全燃烧生成稳定的氧化物时放出的热量。
(2)根据盖斯定律分析,反应热取决于反应物和生成物。
(3)根据温度对反应平衡的影响进行分析。
(4)根据电离平衡常数越大,酸性越强分析。
(1)0.16g CH4完全燃烧放出8.903kJ的热量,即0.01mol甲烷完全燃烧放出的热量,则甲烷的燃烧热为890.3kJ/mol。
(2)根据盖斯定律分析,i.MnCO3(s)![]() MnO(s)+CO2(g) H1=+a kJmol-1;ii.2MnO (s)+ O2(g)
MnO(s)+CO2(g) H1=+a kJmol-1;ii.2MnO (s)+ O2(g)![]() 2MnO2(s) H2=+b kJmol-1,有i×2+ ii得热化学方程式为:2MnCO3(s)+ O2(g)
2MnO2(s) H2=+b kJmol-1,有i×2+ ii得热化学方程式为:2MnCO3(s)+ O2(g)![]() 2MnO2(s) +CO2(g) H=+(2a+b) kJmol-1。
2MnO2(s) +CO2(g) H=+(2a+b) kJmol-1。
(3)甲烧杯中NO2球的红棕色变浅,说明平衡向正反应方向进行,因为该反应为放热反应,说明NH4NO3晶体溶于水为吸热过程。
(4)根据电离平衡常数越大,说明其酸性越强分析,酸性强弱顺序为:CH3COOH>H2CO3>HClO。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案【题目】已知M(g)+N(g) ![]() P(g)+Q(g)反应的平衡常数和温度的关系如下:
P(g)+Q(g)反应的平衡常数和温度的关系如下:
|温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答:
(1)该反应的平衡常数表达式K=_____________ ,△H_____0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的M和0.80mol的N,若反应6s内M的平均反应速率v(M)=0.003 mol·L-1·s-1。,则6s时c(M)=______ mol·L-1, P的物质的量为_______mol;若反应经一段时间后,达到平衡时N的转化率为______。
(3)判断该反应是否达到平衡的依据为_______(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(M)不随时问改变 d.单位时间里生成P和Q的物质的量相等
(4)1200℃时反应P(g)+Q(g) ![]() M(g)+N(g)的平衡常数的值为______________。
M(g)+N(g)的平衡常数的值为______________。
【题目】某实验小组对KSCN的性质进行探究,设计如下实验:
试管中试剂 | 实验 | 滴加试剂 | 现象 |
KSCN溶液 | Ⅰ | i.先加1 mL 0.1 mol/L FeSO4溶液 ii.再加硫酸酸化的KMnO4溶液 | i.无明显现象 ii.先变红,后退色 |
Ⅱ | iii.先滴加1 mL 0.05 mol/L Fe2(SO4)3溶液 iv.再滴加0.5 mL 0.5 mol/L FeSO4溶液 | iii.溶液变红 iv.红色明显变浅 |
(1)①用离子方程式表示实验I溶液变红的原因___________
②针对实验I中红色褪去的原因,小组同学认为是SCN被酸性KMnO4氧化为SO42,并设计如图实验装置证实了猜想是成立的。
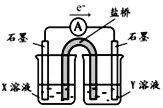
其中X溶液是_____________,检验产物SO42的操作及现象是__________。
(2)针对实验Ⅱ“红色明显变浅”,实验小组提出预测。
原因①:当加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使Fe3++SCN![]() [Fe(SCN)]2+平衡体系中的Fe3+跟SCN结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
[Fe(SCN)]2+平衡体系中的Fe3+跟SCN结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
原因②:SCN可以与Fe2+反应生成无色络合离子,进一步使Fe3++SCN![]() [Fe(SCN)]2+平衡左移,红色明显变浅。
[Fe(SCN)]2+平衡左移,红色明显变浅。
已知:Mg2+与SCN难络合,于是小组设计了如下实验:
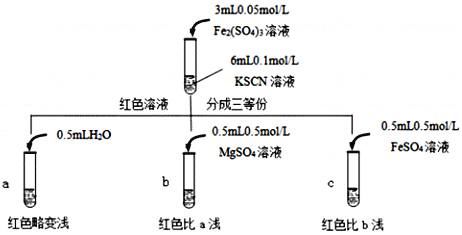
由此推测,实验Ⅱ“红色明显变浅”的原因是___________________________。