题目内容
【题目】某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色。通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下。
编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3溶液/mL | H2O/mL | 反应温度/°C | 溶液变蓝所用时间t/s |
① | 6.0 | 10.0 | 4.0 | 15 | t1 |
② | 6.0 | 14.0 | 0 | 15 | t2 |
③ | 6.0 | a | b | 25 | t3 |
(1)实验①②是探究_______________对反应速率的影响,表中t1_________t2(填“>”、“=”或“<”);实验①③是探究温度对反应速率的影响,表中a=_________,b=_________。
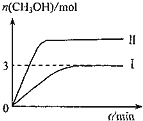
(2)改变反应温度,重复实验③,得到溶液变蓝所需时间(t)与温度(T)的关系如图所示(超过50°C后溶液不会再变蓝)。a、b、c、d四点中,反应速率最快的是_________。(填选项)
A.a点 B.b点 C.c点 D.d点
【答案】浓度 〉 10.0 4.0 D
【解析】
根据影响化学反应速率的因素:浓度、温度、压强、催化剂等进行分析。
(1)实验①②中碘酸钾的浓度不同,因此探究浓度对反应速率的影响,因为②中碘酸钾的浓度大,所以反应速率快,时间短,故有t1〉t2。实验①③中温度不同,是探究温度对反应速率的影响,则各物质的浓度不变,即a=10.0,b=4.0;
(2)因为升温速率加快,所以温度最高的反应速率最快,故选D。

【题目】研究与深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁。高炉炼铁过程中发生的主要反应为:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
温度/°C | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
则该反应的平街常数表达式K=_________,H_________0(填“>”、“<”或“=”)。
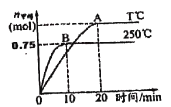
(2)CO2可用于生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),为探究该反应原理,将1 mol CO2和3 mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应,测得甲醇的物质的量随时间的变化如下图所示。
CH3OH(g)+H2O(g),为探究该反应原理,将1 mol CO2和3 mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应,测得甲醇的物质的量随时间的变化如下图所示。
请分析并回答下列问题:
250°C时,反应在前10min的平均速率v(H2)_________molL-1min-1,从反应开始到平衡,CO2转化率为_________%。相同温度下,若某时刻该容器中含有1 mol H2、1.2mol CO2、0.8mol CH3OH、1.5 mol H2O,则此时反应所处的状态为____________________________________(填“向正反应方向进行中”、“向逆反应方向进行中心”或“平衡状态”)。