题目内容
【题目】工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法不正确的是( )
CH3OH(g) △H<0,在容积为1 L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法不正确的是( )
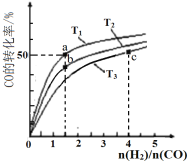
A. H2转化率:a>b>c
B. 上述三种温度之间关系为T1>T2>T3
C. a点状态下再通入0.5 mol CO和0.5 molCH3OH,平衡不移动
D. c点状态下再通入1 molCO和4 mol H2,新平衡中H2的体积分数减小
【答案】B
【解析】
A.由图可知,当n(H2)/n(CO)=1.5时,CO的转化率a![]() b且大于T3下对应CO的转化率,当在温度为T3时,随着n(H2)/n(CO)增大,CO的妆化率增大,H2的转化率减小,所以有a>b>c,故A正确;
b且大于T3下对应CO的转化率,当在温度为T3时,随着n(H2)/n(CO)增大,CO的妆化率增大,H2的转化率减小,所以有a>b>c,故A正确;
B.根据CO(g)+2H2(g)![]() CH3OH(g) △H<0,因为是放热反应,温度升高CO的转化率减小,由图可以看出,当n(H2)/n(CO)相等时,T3
CH3OH(g) △H<0,因为是放热反应,温度升高CO的转化率减小,由图可以看出,当n(H2)/n(CO)相等时,T3![]() T2
T2![]() T1,故B错误;
T1,故B错误;
C.a点时,CO的转化率为50![]() ,起始时CO的物质的量为1mol,H2的物质的量为1.5mol,由此计算平衡常数为4,通过计算再通入0.5 mol CO和0.5 molCH3OH,的浓度商Qc=4,所以平衡不移动,故C正确;
,起始时CO的物质的量为1mol,H2的物质的量为1.5mol,由此计算平衡常数为4,通过计算再通入0.5 mol CO和0.5 molCH3OH,的浓度商Qc=4,所以平衡不移动,故C正确;
D. c点状态下再通入1 molCO和4 mol H2,在等温等容的条件下,投料比不变,相当于加压,平衡向正反应方向移动,新平衡H2的体积分数减小,故D正确;
本题答案为B。

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
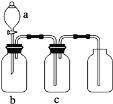
英才点津系列答案【题目】如图装置可用于制取、提纯并收集表格中的四种气体![]() 、b、c表示相应仪器中加入的试剂
、b、c表示相应仪器中加入的试剂![]() ,其中可行的是( )
,其中可行的是( )
选项 | 气体 | a | b | c |
|
A |
| 浓硝酸 | 铜片 | NaOH溶液 | |
B |
| 浓硫酸 | Cu | 酸性 | |
C |
| 浓氨水 | 生石灰 | 碱石灰 | |
D |
| 稀硝酸 |
| 浓硫酸 |
A.A
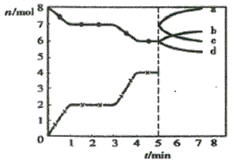
【题目】800°C时,在2L密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g) H<0,测得n(NO)随时间的变化如下表:
2NO2(g) H<0,测得n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)NO的平衡浓度c(NO)=____________________。
(2)下图中表示NO2的变化的曲线______________。(填字母)
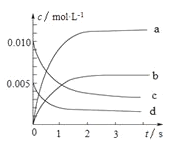
(3)能说明该反应已经达到化学平衡状态的是______________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=v正(O2) D.容器内NO、O2、NO2同时存在
(4)下列操作中,能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
A.及时分离出NO2气体B.适当升高温度
C.增大O2的浓度D.选择高效的催化剂
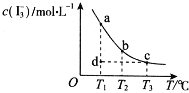
(5)下图中的曲线表示的是其它条件一定时,体系中NO的平衡转化率与温度的关系。图中标有a、b、c、d四点,其中表示v(正)<v(逆)的点是____________。(填选项)
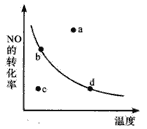
A.a B.b C.c D.d
【题目】下列实验操作、现象与结论对应关系正确的是![]()
选项 | 实验操作 | 实验现象 | 结论 |
A | 常温下铜片插入浓硫酸中 | 无明显现象 | 常温下铜被浓硫酸钝化 |
B | 将 | 溶液红色褪去 |
|
C | 等体积 | HX放出的氢气多且反应速率快 | HX酸性比HY弱 |
D | 先向 | 开始有白色沉淀生成;后又有黑色沉淀生成 |
|
A.AB.BC.CD.D