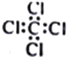题目内容
【题目】根据下列图示所得出的结论正确的是( )
甲 乙
乙
丙 丁
丁
A. 图甲是在不同温度下三个恒容容器中反应2H2(g)+CO(g)CH3OH(g) ΔH<0的平衡曲线,曲线X对应的温度相对较高
B. 图乙是一定温度下三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线,a点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO32-)
C. 图丙为MOH和ROH两种一元碱水溶液在常温下分别加水稀释时pH的变化曲线,可知ROH是强碱
D. 图丁为两个容器中在不同的压强下各投入1 mol CH4和1 mol CO2所发生反应CH4(g)+CO2(g)2CO(g)+2H2(g)的平衡曲线,N点化学平衡常数K=1
【答案】BC
【解析】
应用平衡移动原理,分析外因对化学平衡、沉淀溶解平衡、电离平衡的影响,判断由图象得出的结论是否正确。
A项:在图甲中作任一垂线,与三曲线各有一交点,表明在反应物比例相同时,X曲线对应温度下CO平衡转化率较高。因反应的ΔH<0,故X曲线对应温度较低,A项错误;
B项:过a点作垂线,与MgCO3直线有交点(饱和溶液)。可见,在c(CO32-)相同时,a点溶液中c(Mg2+)比饱和溶液中的小,为不饱和溶液。a点时-lgc(Mg2+)> -lgc(CO32-),则c(Mg2+)<c(CO32-),B项正确;
C项:图丙中ROH加水稀释10倍、100倍或1000倍时,溶液pH减小1、2或3,则ROH是强碱,C项正确;
D项:化学平衡常数只与温度有关,N点的平衡常数可用M点计算。平衡时CH4(g)、CO2(g)的浓度都是0.5mol/L,CO(g)、H2(g)的浓度都是1 mol/L,则K=4,D项错误。
本题选BC。

 阅读快车系列答案
阅读快车系列答案【题目】某兴趣小组用铝箔制备Al2O3、AlCl3·6H2O及明矾大晶体,具体流程如下

已知:(1) AlCl3·6H2O易溶于水、乙醇及乙醚;
(2) 明矾在水中的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 |
溶解度/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 | 24.8 | 71.0 | 109 |
(1)步骤Ⅱ中生成Al(OH)3的离子方程式为____________________________________________。
(2)步骤Ⅲ灼烧Al(OH)3所用实验室常用仪器为________,为了提高Al2O3纯度,需________(填操作步骤)。
(3)制备AlCl3·6H2O的工业生产中,胶状固体用酸浸取后,还需要通入HCl气体。通入HCl的作用主要有两点:____________和____________。
(4)已知:在不同温度条件下向一定量的氯化铝溶液中通入HCl气体,通入量对AlCl3·6H2O结晶量和结晶效率的影响如图,请补充完整由胶状固体制备AlCl3·6H2O晶体的实验方案:向胶状固体滴加一定浓度盐酸,直至恰好完全溶解,__________________________。