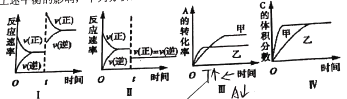
题目内容
【题目】800°C时,在2L密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g) H<0,测得n(NO)随时间的变化如下表:
2NO2(g) H<0,测得n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)NO的平衡浓度c(NO)=____________________。
(2)下图中表示NO2的变化的曲线______________。(填字母)
(3)能说明该反应已经达到化学平衡状态的是______________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=v正(O2) D.容器内NO、O2、NO2同时存在
(4)下列操作中,能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
A.及时分离出NO2气体B.适当升高温度
C.增大O2的浓度D.选择高效的催化剂
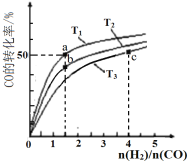
(5)下图中的曲线表示的是其它条件一定时,体系中NO的平衡转化率与温度的关系。图中标有a、b、c、d四点,其中表示v(正)<v(逆)的点是____________。(填选项)
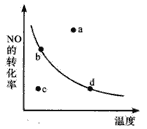
A.a B.b C.c D.d
【答案】0.035mol/L b B C A
【解析】
(1)根据平衡时浓度不变分析;
(2)结合方程式分析平衡时二氧化氮的浓度,进而确定曲线;
(3)根据平衡的判断依据进行分析;
(4)条件对反应速率和平衡的影响分析;
(5)根据反应都要到平衡分析各点的进行方向。
(1)根据表中数据分析,平衡时一氧化氮时的浓度为![]() ;
;
(2)根据方程式计算分析,二氧化氮的平衡浓度为0.065mol/L,所以b为该曲线;
(3)A.v(NO2)=2v(O2)没有说明反应的方向,不能说明反应到平衡,故A错误;
B.容器内压强保持不变可以说明反应到平衡,故B正确;
C.v逆(NO)=v正(O2) 表示正逆反应速率不相等,故C错误;
D.可逆反应中反应物和生成物同时存在,故容器内NO、O2、NO2同时存在不能说明到平衡,故D错误;
故选B。
(4)A.及时分离出NO2气体,反应速率减慢,平衡正向移动,故A错误;
B.适当升高温度,反应增大,平衡逆向移动,故B错误;
C.增大O2的浓度,反应速率增大,平衡正向移动,故C正确;
D.选择高效的催化剂,反应速率增大,但平衡不移动,故C错误;
故选C。
(5)曲线上的各点为平衡点,正逆反应速率相等,a点一氧化氮的转化率比平衡时高,说明该反应向逆向进行,即正反应速率小于逆反应速率,故正确;c点一氧化氮转化率比平衡时低,说明该反应向正向进行,正反应速率大于逆反应速率。故选A。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】为实现下列实验目的,下表提供的主要仪器以及所用试剂均合理的是( )
选项 | 实验目的 | 主要仪器 | 试剂 |
A | 配制480mL | 胶头滴管、烧杯、玻璃棒、托盘天平、480mL容量瓶 | NaOH固体、蒸馏水 |
B | 分离 | 分液漏斗、烧杯 | 乙醇 |
C | 鉴别 | 试管、胶头滴管 | 澄清石灰水 |
D | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液 |
A.AB.BC.CD.D