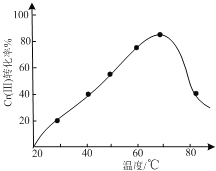
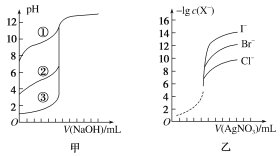
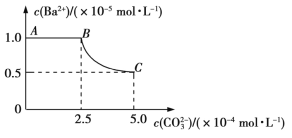
0 201773 201781 201787 201791 201797 201799 201803 201809 201811 201817 201823 201827 201829 201833 201839 201841 201847 201851 201853 201857 201859 201863 201865 201867 201868 201869 201871 201872 201873 201875 201877 201881 201883 201887 201889 201893 201899 201901 201907 201911 201913 201917 201923 201929 201931 201937 201941 201943 201949 201953 201959 201967 203614