题目内容
【题目】氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质。一旦泄漏需要及时处理,一般可以通过喷洒双氧水或过硫酸钠(Na2S2O8)溶液来处理,以减轻环境污染。
Ⅰ.已知:氰化钠是一种白色结晶颗粒,化学式为NaCN,有剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)请设计实验证明N、C元素的非金属性强弱:________。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的离子方程式是________。
Ⅱ.工业制备过硫酸钠的反应原理如下:
主反应:(NH4)2S2O8 + 2NaOH ![]() Na2S2O8 + 2NH3↑ + 2H2O
Na2S2O8 + 2NH3↑ + 2H2O
副反应:3Na2S2O8 + 2NH3 + 6NaOH![]() 6Na2SO4 + N2 + 6H2O
6Na2SO4 + N2 + 6H2O
某化学兴趣小组利用上述原理在实验室制备过硫酸钠,并检测用过硫酸钠溶液处理后的氰化钠废水是否达标排放。
(实验一)实验室通过如图所示装置制备Na2S2O8。

(3)装置b的作用是________。
(4)装置a中反应产生的气体需要持续通入装置c的原因是________。
(5)上述装置中还需补充的实验仪器或装置有________![]() 填字母
填字母![]() 。
。
A.温度计
B.洗气瓶
C.水浴装置
D.酒精灯
(实验二)测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mgL-1。
②Ag+ + 2CN- = [Ag(CN)2]-,Ag+ + I- = AgI↓,AgI呈黄色,且CN-优先与CN-反应。实验如下:取100.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol·L-1的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50 mL。
(6)滴定终点的现象是________。
(7)处理后的废水中氰化钠的浓度为_______ mgL-1;处理后的废水是否达到排放标准?_______(填“是”或“否”)。
【答案】取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明硝酸酸性强于碳酸,则非金属性:N > C 作安全瓶,防止倒吸 CN- + H2O2 + H2O = HCO3- + NH3↑ 将三颈烧瓶中产生的NH3及时排出,减少副反应的发生 ACD 滴入最后一滴硝酸银溶液时,溶液中出现淡黄色沉淀,且半分钟内沉淀不消失 0.147 是
【解析】
⑴取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明硝酸酸性强于碳酸。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,由物质性质及元素守恒可知酸式盐应为碳酸氢盐,气体为氨气。
⑶装置b的作用是作安全瓶,防止倒吸。
⑷将三颈烧瓶中产生的NH3及时排出,减少副反应的发生。
⑸上述装置中还需补充的实验仪器或装置有温度计、水浴装置、酒精灯。
⑹滴定终点的现象是滴入最后一滴硝酸银溶液时,溶液中出现淡黄色沉淀。
⑺先计算消耗AgNO3的物质的量,再根据方程式计算处理的废水中氰化钠的质量,再计算废水中氰化钠的含量。
⑴设计实验证明N、C元素的非金属性强弱为:取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明硝酸酸性强于碳酸,则非金属性:N > C;故答案为:取少量碳酸氢钠于试管中,加入稀硝酸,有无色气泡产生,说明硝酸酸性强于碳酸,则非金属性:N > C。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,由物质性质及元素守恒可知酸式盐应为碳酸氢盐,气体为氨气,该反应的离子方程式是:
CN- + H2O2 + H2O = HCO3- + NH3↑;故答案为:CN- + H2O2 + H2O = HCO3- + NH3↑。
⑶装置b的作用是作安全瓶,防止倒吸;故答案为:作安全瓶、防止倒吸。
⑷装置a中反应产生的气体需要持续通入装置c的原因是:将三颈烧瓶中产生的NH3及时排出,减少副反应的发生;故答案为:将三颈烧瓶中产生的NH3及时排出,减少副反应的发生。
⑸上述装置中还需补充的实验仪器或装置有温度计、水浴装置、酒精灯,故ACD正确;
故答案为:ACD。
⑹滴定终点的现象是:滴入最后一滴硝酸银溶液时,溶液中出现淡黄色沉淀,且半分钟内沉淀不消失;故答案为:滴入最后一滴硝酸银溶液时,溶液中出现淡黄色沉淀,且半分钟内沉淀不消失。
⑺消耗AgNO3的物质的量为1.00×10-4mol·L-1×1.50×10-3L=1.5×10-7mol,根据方程式Ag+ + 2CN- = [Ag(CN)2]-,处理的废水中氰化钠的质量为1.5×10-7mol×2×49 gmol-1 = 1.47×10-5g = 1.47×10-2mg,废水中氰化钠的含量为![]() ,小于0.50mgL-1,所以达到排放标准。故答案为:0.147;是。
,小于0.50mgL-1,所以达到排放标准。故答案为:0.147;是。

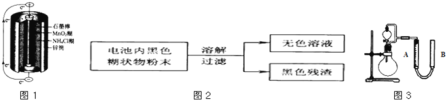
【题目】锌锰干电池是最早使用的化学电池,其基本构造如图1所示.
(1)锌锰干电池的负极电极反应式是 ______ ,电路中每通过0.4mol e-,负极质量减少 ______ g;工作时NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是 ______ 。
(2)某研究小组对电池内黑色糊状物进行了如图2所示实验
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告:
实验步骤 | 实验现象 | 实验结论 |
①取少量上述无色溶液于试管中,逐滴加入NaOH溶液,直至过量。 | 生成白色沉淀, ______ | 无色溶液中 存在Zn2+离子 |
② ______ | ______ | 无色溶液中 存在NH4+离子 |
(3)利用残渣中分离出的MnO2,研究其在H2O2制O2过程中的作用.实验装置如图3所示.将等物质的量浓度、等体积H2O2溶液加入分液漏斗中,分别进行2个实验(气体的体积在相同条件下测定)。
序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
实验二 | 足量MnO2 和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 | ______ ______ |
①实验一、二中参加反应的H2O2的物质的量之比为 ______ ;
②实验二中反应的离子方程式为 ______ ;
③在测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,还需要注意____ 。
【题目】下列实验中根据现象得出的结论错误的是
选项 | 实验 | 现象 | 结论 |
A | 向 | 先出现白色沉淀,最终沉淀又溶解 | Y可能是 |
B | 向某溶液中加入Cu和浓 | 试管口有红棕色气体产生 | 原溶液可能含有 |
C | 将Na投到一定浓度的 | 出现气泡并有固体生成 | Na与 |
D | 向浓度均为 | 先出现蓝色沉淀 |
|
A.AB.