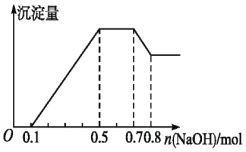
题目内容
【题目】工业含铬废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。利用硫酸工业废气中的SO2处理含铬废水,既充分利用资源、以废治废,还能节约生产成本。
(1)工业上处理100L Cr2O72-含量为108mgL-1的含铬废水,至少需要______L(标准状况) SO2。
(2)已知:Ksp[Cr(OH)3]=1×10-30,室温下,除去被SO2还原所得溶液中的Cr3+(使其浓度小于1×10-6molL-1),需调节溶液pH______。
(3)三价铬Cr(III)与双氧水反应可用于合成铬黄(PbCrO4),控制其他条件不变,调节反应温度,考察反应温度对Cr(III)转化率的影响(如图所示),温度超过70℃时,Cr(III)转化率下降的原因是______。
(4)光照下,草酸(H2C2O4)也能将Cr2O72-转化为Cr3+,化学式为Al2Fe(SO4)4的某发盐(毛发状,在空气中能被氧化)对该反应具有催化作用,为确定一瓶久置发盐的化学成分,学习小组进行如下实验:
取一定质量的发盐样品溶于足量的稀硫酸中,将溶液分为两等份,其中一份与酸性KMnO4溶液充分反应(反应后MnO4-被还原成Mn2+),消耗浓度为0.4000molL-1的KMnO4溶液20.00mL;往另一份溶液中加入足量稀氨水,在空气中微热并搅拌使之充分反应,待沉淀不再变化后过滤,将沉淀洗涤并充分灼烧后称量,得9.100g干燥固体粉末。通过计算与合理猜想,推测该久置发盐的可能化学组成(请给出计算过程与推测理由)。_________

【答案】3.36 > 6 较高温度下双氧水分解 Al10Fe5(OH)(SO4)20或Al20Fe10(CO3)(SO4)40
【解析】
(1)先计算含铬废水中含Cr2O72-物质的质量,再计算物质的量,再根据电子转移守恒计算消耗气体的物质的量。
⑵先计算氢氧根浓度,再计算氢离子浓度,最后得pH。。
(3)温度升高超过70℃时过氧化氢分解。
⑷先计算n(Fe2+),再根据关系得出n(Al3+),再根据固体粉末求n(Al2O3) 和n(Fe2O3),根据久置的发盐中的阳离子所带电荷总数分析,阳离子多点电荷大于已知的阴离子所带电荷总数,得出还可能存在OH-或CO32-,再根据比例关系得出化学式。
(1) 100L Cr2O72-含量为108mgL-1的含铬废水中含Cr2O72-物质的质量![]() ,物质的量n(Cr2O72-)
,物质的量n(Cr2O72-)![]() ,根据电子转移守恒:
,根据电子转移守恒:

1mol:0.05mol = 3mol:n
解得n = 0.15mol,标准状况下体积![]() ;故答案为:3.36。
;故答案为:3.36。
⑵室温下,除去被SO2还原所得溶液中的Cr3+(使其浓度小于1×10-6molL-1),![]() ,则
,则![]() ,
,![]() ,则pH = 6,需调节溶液pH > 6;故答案为:> 6。
,则pH = 6,需调节溶液pH > 6;故答案为:> 6。
(3)三价铬Cr(III)与双氧水反应可用于合成铬黄(PbCrO4),发生的是氧化还原反应,图象分析可知反应达到平衡状态达到最大转化率,温度升高超过70℃时过氧化氢分解,使平衡逆向进行,Cr(III)转化率下降;故答案为:较高温度下双氧水分解。
⑷n(KMnO4) = 0.4000 molL-1×0.02L = 0.008mol,n(Fe2+)=5 n(KMnO4) = 50×0.008mol =0.04mol,依据发盐的化学式可知在久置的发盐中n(Al3+) = 2×[0.04mol + n(Fe3+)],加入氨水后生成的干燥固体粉末中: n(Al2O3) = 0.04mol + n(Fe3+),n(Fe2O3) = ![]() [0.04mol + n(Fe3+)],102gmol-1×[0.04mol + n(Fe3+)] + 160gmol-1×
[0.04mol + n(Fe3+)],102gmol-1×[0.04mol + n(Fe3+)] + 160gmol-1×![]() [0.04mol + n(Fe3+)] = 9.10g
[0.04mol + n(Fe3+)] = 9.10g
n(Fe3+) = 0.01mol,n(Al3+) = 2×[0.04mol + n(Fe3+)] = 0.1mol,n(SO42-)=2 n(Al3+) =0.2mol,久置的发盐中的阳离子所带电荷总数:3 n(Al3+) + 2n(Fe2+) +3 n(Fe3+) = 0.41mol,而已知的阴离子所带电荷总数2n(SO42-)=0.4mol <0.41 mol,由于发盐在空气中被氧化,故其中还可能存在0.01molOH-或0.005mol CO32-,该发盐的可能组成为
n(Al3+):[ n(Fe2+) + n(Fe3+)]:n(OH-): n(SO42-) = 0.1:0.05:0.01:0.2 = 10:5:1:20,化学式为Al10Fe5(OH)(SO4)20,n(Al3+):[ n(Fe2+) + n(Fe3+)]:n(CO32-): n(SO42-)= 0.1:0.05:0.005:0.2 = 20:10:1:40,化学式为Al20Fe10(CO3)(SO4)40;故该久置发盐的可能化学组成为Al10Fe5(OH)(SO4)20或Al20Fe10(CO3)(SO4)40。

 阅读快车系列答案
阅读快车系列答案【题目】某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究。
[探究目的] 分析黑色粉末X的组成,并进行相关实验。
[查阅资料]
①CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。
②Fe3O4+8H+=2Fe3++Fe2++4H2O
③Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
④3Fe3O4+28HNO3(稀)=9Fe(NO3)3+NO↑+14H2O
[实验探究]
I.定性检验
编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
(1)实验③发生的反应的离子方程式为_____________________________。
(2)上述实验说明黑色粉末X中含有_______________________________。
II.定量测定
根据下图所示的实验方案进行实验并记录数据:
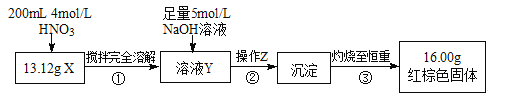
(1)操作Z的名称是_________。
(2)通过以上数据,得出13.12g黑色粉末X中各成分的物质的量为_________。
(3)若溶液Y的体积仍为200mL,则溶液Y中c(Fe3+)=________mol/L。
【题目】在T ℃时,某NaOH稀溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如下表所示:
序号 | NaOH溶液体积 | 盐酸体积 | 溶液pH |
① | 20.00 | 0.00 | 8 |
② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为( )
A.1B.6C.5D.4
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断正确的是( )
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
A.实验①反应后的溶液中:c(A﹣)>c(K+)>c(OH﹣)>c(H+)
B.实验①反应后的溶液中:c(OH﹣)=c(K+)﹣c(A﹣)=![]() mol/L
mol/L
C.实验②反应后的溶液中:c(A﹣)+c(HA)<0.1 mol/L
D.实验②反应后的溶液中:c(K+)+c(OH﹣)=c(H+)+c(A﹣)