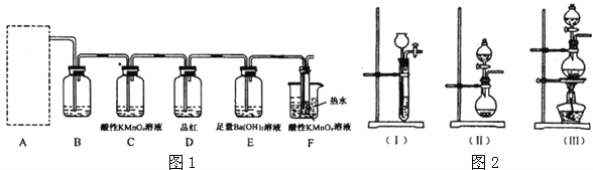
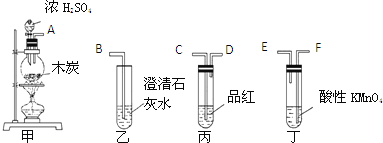
题目内容
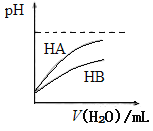
【题目】一定温度下,将足量的BaSO4固体溶于50 mL水中,充分搅拌,慢慢加入Na2CO3固体,随着c(![]() )增大,溶液中c(Ba2+)的变化曲线如图所示。则下列说法正确的是
)增大,溶液中c(Ba2+)的变化曲线如图所示。则下列说法正确的是

A. 该温度下Ksp(BaSO4)>Ksp(BaCO3)
B. 加入Na2CO3固体,立即有BaCO3固体生成
C. BaCO3的Ksp=2.5×10-10
D. 曲线BC段内,c(![]() )∶c(
)∶c(![]() )=25
)=25
【答案】D
【解析】
A、当c(![]() )=0时,c(
)=0时,c(![]() )=c(Ba2+)=1.0×10-5 mol·L-1, BaSO4的溶度积Ksp=1.0×10-5×1.0×10-5=1.0×10-10。由图可知当c(
)=c(Ba2+)=1.0×10-5 mol·L-1, BaSO4的溶度积Ksp=1.0×10-5×1.0×10-5=1.0×10-10。由图可知当c(![]() )>2.5×10-4 mol·L-1时,开始有BaCO3生成,BaCO3的溶度积Ksp=2.5×10-4×1.0×10-5=2.5×10-9,故A错误;B、根据A选项分析,当加入Na2CO3浓度为2.5×10-4mol·L-1时,才有BaCO3沉淀,故B错误;C、根据A选项分析,故C错误;D、曲线BC段内,BaSO4(s)和BaCO3(s)在溶液中都达到了沉淀溶解平衡状态,故
)>2.5×10-4 mol·L-1时,开始有BaCO3生成,BaCO3的溶度积Ksp=2.5×10-4×1.0×10-5=2.5×10-9,故A错误;B、根据A选项分析,当加入Na2CO3浓度为2.5×10-4mol·L-1时,才有BaCO3沉淀,故B错误;C、根据A选项分析,故C错误;D、曲线BC段内,BaSO4(s)和BaCO3(s)在溶液中都达到了沉淀溶解平衡状态,故![]() =
=![]() =
=![]() =
=![]() =25,故D正确。
=25,故D正确。

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目