【题目】下列有关硫、氮单质及其化合物的叙述正确的是( )
A.SO2、NO2均为酸性氧化物
B.“雷雨肥庄稼”与氮的固定有关
C.硫粉在过量的纯氧中燃烧可以生成SO3
D.亚硫酸钠可长期暴露在空气中,不易变质
【题目】25 ℃时,几种弱酸的电离常数如下:
弱酸的化学式 | CH3COOH | HCN | H2S |
电离常数(25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
25 ℃时,下列说法正确的是
A.等物质的量浓度的各溶液的pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
D.某浓度的HCN溶液的pH=d,则其中c(OH-)=10-d mol/L
【题目】甲醇既是基本有机化工原料,又可作为燃料用于替代矿物燃料。
(1)工业上合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
平衡常数K | 2.041 | 0.270 | 0.012 |
由表中数据判断该反应为 ________反应(填“吸热”或“放热”)。 某温度下,将2 molCO和6 molH2充入2 L的密闭容器中充分反应,达到平衡后,测得c(CO)=0.2 mol/L,则CO的转化率为______,此时的温度为______(从表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2kJ/mol
③H2O(g)=H2O(l) ΔH3kJ/mol
则反应CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH= _____________ kJ/mol(用ΔH1、ΔH2、ΔH3表示)。
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72)时,实验室利用如图装置模拟该法:

①N电极的电极反应式为 ___________________________________。
②请完成电解池中Cr2O72转化为Cr3+的离子反应方程式:
Cr2O72 + ______ Fe2+ + ______ = ______ Cr3+ + ______ Fe3+ + ______
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×105 mol/L时,Cr3+沉淀完全,此时溶液的pH=______。(已知:Ksp=6.4×1031,lg2=0.3)
【题目】回答下列问题:
(1)氯化铁水溶液呈酸性,原因是(用离子方程式表示)_________________________。实验室在临时配制一些氯化铁溶液时,常将氯化铁固体先溶于较浓的__________中,然后再用蒸馏水稀释到所需要的浓度,是为了抑制其水解。
(2)25℃时,浓度为0.1 mol/L的6种溶液:①HCl ②CH3COOH ③Ba(OH)2 ④ Na2CO3 ⑤ KCl ⑥NH4Cl,溶液的pH由小到大的顺序为________(填序号)[已知Kb(NH3·H2O)=1.8×10-5,Ka(CH3COOH)=1.75×10-5]。
(3)电离平衡常数可用来衡量弱电解质的电离程度。已知如下表数据(25℃):
化学式 | HCN | CH3COOH | H2CO3 |
电离平衡常数 | K=4.9×1010 | K=1.8×105 | K1=4.4×107 K2=4.7×1011 |
①25 ℃时,等物质的量浓度的3种溶液:a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液,其pH由大到小的顺序为________________(填序号)。
②25 ℃时,向NaCN溶液中通入少量的CO2,发生反应的离子方程式为_________________。
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中的Cl恰好完全沉淀(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为__________mol·L1,此时溶液中c(CrO42)为_________mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
【题目】我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
Ⅰ.已知:2CO(g) + O2(g)=2CO2(g) ΔH=-566 kJ/mol
2Fe(s) + 3/2O2(g)=Fe2O3(s) ΔH=-825.5 kJ/mol
反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ΔH=________ kJ/mol。
2Fe(s)+3CO2(g) ΔH=________ kJ/mol。
Ⅱ.反应1/3Fe2O3(s)+CO(g)![]() 2/3 Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一容积为10 L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡。
2/3 Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一容积为10 L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡。
(1)CO的平衡转化率为 __________。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是 _________。
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下与H2反应制备甲醇: CO(g)+2H2(g)![]() CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
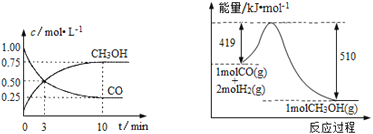
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率υ(H2)=_____________。
(2)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
容器 | 反应物投入的量 | 反应物 转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
甲 | 1 molCO和2 molH2 | α1 | c1 | 放出Q1 kJ热量 |
乙 | 1 molCH3OH | α2 | c2 | 吸收Q2 kJ热量 |
丙 | 2 molCO和4 molH2 | α3 | c3 | 放出Q3 kJ热量 |
则下列关系正确的是 _________(填序号)。
A.c1=c2;B.2Q1=Q3;C.2α1=α3;D.α1+α2=1;E.该反应若生成1 molCH3OH,则放出(Q1+Q2)kJ热量