题目内容
【题目】我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
Ⅰ.已知:2CO(g) + O2(g)=2CO2(g) ΔH=-566 kJ/mol
2Fe(s) + 3/2O2(g)=Fe2O3(s) ΔH=-825.5 kJ/mol
反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ΔH=________ kJ/mol。
2Fe(s)+3CO2(g) ΔH=________ kJ/mol。
Ⅱ.反应1/3Fe2O3(s)+CO(g)![]() 2/3 Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一容积为10 L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡。
2/3 Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一容积为10 L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡。
(1)CO的平衡转化率为 __________。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是 _________。
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
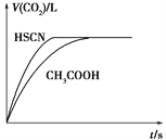
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下与H2反应制备甲醇: CO(g)+2H2(g)![]() CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
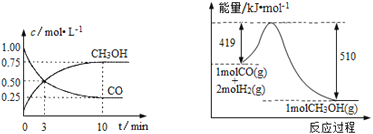
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率υ(H2)=_____________。
(2)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
容器 | 反应物投入的量 | 反应物 转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
甲 | 1 molCO和2 molH2 | α1 | c1 | 放出Q1 kJ热量 |
乙 | 1 molCH3OH | α2 | c2 | 吸收Q2 kJ热量 |
丙 | 2 molCO和4 molH2 | α3 | c3 | 放出Q3 kJ热量 |
则下列关系正确的是 _________(填序号)。
A.c1=c2;B.2Q1=Q3;C.2α1=α3;D.α1+α2=1;E.该反应若生成1 molCH3OH,则放出(Q1+Q2)kJ热量
【答案】-23.5 60% d 0.15mol/(Lmin) ADE
【解析】
I.依据热化学方程式和盖斯定律计算得到需要的热化学方程式;
II.(1)令平衡时CO的物质的量变化为nmol,利用三段式表示出平衡时CO、CO2的物质的量,化学计量数都是1,利用物质的量代替浓度代入平衡常数计算n的值,进而计算CO的浓度变化量,再利用转化率定义计算CO的转化率;
(2)提高CO的平衡转化率,应使平衡向正反应移动,但不能增大CO的用量,结合选项根据平衡移动原理分析;
III.(1)根据图象中生成甲醇的量求出消耗的氢气的量,再求出氢气的反应速率;
(2)甲容器反应物投入1molCO 2molH2与乙容器反应物投入1mol CH3OH在保持恒温、恒容情况下是等效平衡,平衡时CH3OH的浓度c1=c2、α1+α2=1、Q1+Q2能量总变化相当于1molCO.2molH2完全转化成1mol CH3OH的能量,即吸放热Q1+Q2数值上就等于90.8kJ;甲容器反应物投入量1molCO、2molH2与丙容器反应物投入量2molCO、4molH2,若恒温且丙容器容积是甲容器2倍,则甲容器与丙容器也是等效平衡,然而现在是温度、容积相同的3个密闭容器,可以当成是在恒温且容积是甲容器两倍条件下,体积受到了压缩,原反应正向气体体积减少,由平衡移动原理,则相较于甲容器(或假设状况)而言,丙容器平衡向正向移动,也就是说,丙容器的转化率比甲容器还要大一些.因此2c1<c3、α2<α3。
I.①2CO(g) + O2(g)=2CO2(g) ΔH=-566 kJ/mol
②2Fe(s) + 3/2O2(g)=Fe2O3(s) ΔH=-825.5 kJ/mol
由盖斯定律①×![]() ②得到Fe2O3(s)+3CO(g)
②得到Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
则△H=566×![]() +825.5=23.5kJ/mol,
+825.5=23.5kJ/mol,
故答案为:23.5;
Ⅱ.(1)令平衡时CO的物质的量变化为nmol,则:
1/3Fe2O3(s)+CO(g)![]() 2/3 Fe(s)+CO2(g)
2/3 Fe(s)+CO2(g)
开始(mol) 1 1
变化(mol) n n
平衡(mol) 1n n+1
所以![]() =4,解得n=0.6,则CO的平衡转化率为
=4,解得n=0.6,则CO的平衡转化率为![]() ×100%=60%,故答案为:60%;
×100%=60%,故答案为:60%;
(2)a、该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故a不符合题意;
b、反应前后气体的物质的量不变,增大压强平衡不移动,CO的平衡转化率不变,故b不符合题意;
c、加入合适的催化剂,平衡不移动,故c不符合题意;
d、移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故d符合题意;
e、粉碎矿石,使其与平衡混合气体充分接触,平衡不移动,故e不符合题意;
故选d;
Ⅲ.(1)达到平衡时生成甲醇为:0.75mol/L,则消耗的c(H2)=2×0.75mol/L=1.5mol/L,v(H2)=![]() ═
═![]() =0.15mol/(Lmin);
=0.15mol/(Lmin);
(2)A、甲、乙相比较,把乙等效为开始加入1molCO和2molH2,和甲是等效的,甲乙是等效平衡,所以平衡时甲醇的浓度c1=c2,故A正确;
B、甲、丙相比较,丙中反应物的物质的量为甲的2倍,相当于压强增大,对于反应CO(g)+2H2(g)![]() CH3OH(g),平衡向生成甲醇的方向移动,故2Q1<Q3,故B错误;
CH3OH(g),平衡向生成甲醇的方向移动,故2Q1<Q3,故B错误;
C、甲、丙相比较,丙中反应物的物质的量为甲的2倍,相当于压强增大,对于反应CO(g)+2H2(g)![]() CH3OH(g),平衡向生成甲醇的方向移动,故α1<α3,故C错误;
CH3OH(g),平衡向生成甲醇的方向移动,故α1<α3,故C错误;
D、甲、乙处于相同的平衡状态,而且反应方向相反,则α1+α2=1,故D正确;
E、甲、乙处于相同的平衡状态,而且反应方向相反,两个方向转化的和恰好为1mol,所以该反应若生成1molCH3OH,则放出(Q1+Q2)kJ热量,故E正确;
故答案为:ADE。

【题目】下列有关硫、氮单质及其化合物的叙述正确的是( )
A.SO2、NO2均为酸性氧化物
B.“雷雨肥庄稼”与氮的固定有关
C.硫粉在过量的纯氧中燃烧可以生成SO3
D.亚硫酸钠可长期暴露在空气中,不易变质
【题目】已知下表为![]() 时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是( )
| HClO |
|
|
|
|
A.向NaClO溶液中通入少量二氧化碳的离子方程式为:![]()
B.相同浓度的![]() 和NaClO的混合溶液中,
和NaClO的混合溶液中,![]()
C.向![]() 溶液中加入少量水,溶液中pH增大
溶液中加入少量水,溶液中pH增大
D.25℃时,![]() 溶液通入
溶液通入![]() 至溶液的
至溶液的![]() 时,溶液中:
时,溶液中:![]()