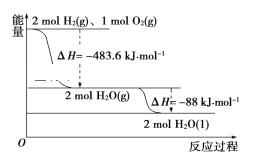
题目内容
【题目】一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图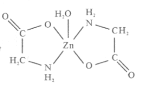 。
。
(1)基态Zn2+的价电子排布式为_______________;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的顺序是___________________。
(2)甘氨酸(H2N-CH2-COOH)中N的杂化轨道类型为______________;甘氨酸易溶于水,试从结构角度解释___________________________________________。
(3)一水合甘氨酸锌中Zn2+的配位数为______________________。
(4) [Zn(IMI)4](ClO4)2是Zn2+的另一种配合物,IMI的结构为![]() ,则1 mol IMI中含有________个σ键。
,则1 mol IMI中含有________个σ键。
(5)常温下IMI的某种衍生物与甘氨酸形成的离子化合物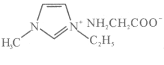 为液态而非固态,原因是________________________________________。
为液态而非固态,原因是________________________________________。
(6)Zn与S形成某种化合物的晶胞如图Ⅰ所示。
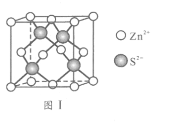
①Zn2+填入S2-组成的________________空隙中;
②由①能否判断出S2- 、Zn2+相切?_________(填“能”或“否”);已知晶体密度为d g/cm3,S2-半径为a pm,若要使S2-、Zn2+相切,则Zn2+半径为____________________pm(写计算表达式)。
【答案】3d10 O>N>C>H sp3 甘氨酸为极性分子,且分子中的氨基和羧基都能与水分子形成氢键 5 12NA 阴阳离子半径大,电荷小,形成的离子晶体晶格能小,熔点低 正四面体 否 (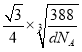 ×1010-a)pm
×1010-a)pm
【解析】
(1)Zn的核电荷数为30,处于周期表中第4周期第ⅡB族,基态Zn2+的价电子排布式为3d10;
C、N、O是同一周期的元素,从左到右电负性减小,电负性由大到小的顺序是O>N>C>H。
(2)N原子价层电子对个数是4,杂化轨道类型为sp3;
从分子极性和氢键两个角度解释;
(3)根据配位数的定义判断;
(4)1 mol IMI中含有5molC-N、6molC-H、1molC-H,共12×6.02×1023个σ键。
(5)从晶格能大小的角度解释;
(6)S2-做面心立方最密堆积,Zn2+做四面体填隙,根据结合晶胞边长和体对角线的关系、密度公式ρ=m÷V计算。
(1)Zn为30号元素,基态Zn2+的价电子排布式为3d10;一水合甘氨酸锌中所涉及的非金属元素C、N、O、H,C、N、O是同一周期的元素,从左到右电负性减小,电负性由大到小的顺序是O>N>C>H。
(2)甘氨酸(H2N-CH2-COOH)中N原子形成三个σ键,孤电子对为![]() =1,N原子价层电子对个数是4,杂化轨道类型为sp3;
=1,N原子价层电子对个数是4,杂化轨道类型为sp3;
甘氨酸易溶于水,因为:甘氨酸极性分子,且分子中的氨基和羧基都能与水分子形成氢键。
(3)Zn与甘氨酸中的氧和氮原子形成4个配位键,和水中氧形成一个配位键,一水合甘氨酸锌中Zn2+的配位数为5。
(4) [Zn(IMI)4](ClO4)2是Zn2+的另一种配合物,IMI的结构为![]() ,则1 mol IMI中含有5molC-N、6molC-H、1molC-H,共12×6.02×1023个σ键。
,则1 mol IMI中含有5molC-N、6molC-H、1molC-H,共12×6.02×1023个σ键。
(5)常温下IMI的某种衍生物与甘氨酸形成的离子化合物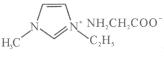 为液态而非固态,原因是阴阳离子半径大,电荷小,形成的离子晶体晶格能小,熔点低。
为液态而非固态,原因是阴阳离子半径大,电荷小,形成的离子晶体晶格能小,熔点低。
(6)①S2-为面心立方最密堆积,Zn2+做四面体填隙,所以晶体中与Zn2+等距且最近的S2-形成的立体图形为正四面体形,Zn2+填入S2-组成的正四面体空隙中;
②由①不能判断出S2- 、Zn2+相切;晶体的密度为dg·cm-3,阿伏伽德罗常数为NA,一个晶胞中含有Zn2+的个数为4,S2-的个数为8×![]() +6×
+6×![]() =4个,不妨取1mol这样的晶胞,即有NA个这样的晶胞,设晶胞的边长为Ccm,一个晶胞的体积为V=c3cm3,则晶体密度为ρ=
=4个,不妨取1mol这样的晶胞,即有NA个这样的晶胞,设晶胞的边长为Ccm,一个晶胞的体积为V=c3cm3,则晶体密度为ρ=![]() =
=![]() ,所以C=
,所以C=![]() cm,由于晶体中Zn2+和S2-原子之间的最短距离为体对角线的
cm,由于晶体中Zn2+和S2-原子之间的最短距离为体对角线的![]() ,所以该晶体中S2-和Zn2+之间的最短距离为
,所以该晶体中S2-和Zn2+之间的最短距离为![]() cm=
cm=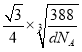 cm,S2-半径为a pm,若要使S2-、Zn2+相切,则Zn2+半径为(
cm,S2-半径为a pm,若要使S2-、Zn2+相切,则Zn2+半径为(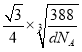 ×1010-a)pm。
×1010-a)pm。

【题目】下列有关物质检验的实验操作、现象及结论均正确的是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO |
B | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定为SO2 |
D | 向某溶液中加入氢氧化钠溶液并加热,产生有刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红 | 该溶液中一定含有NH |
A.AB.BC.CD.D