题目内容
【题目】回答下列问题:
(1)氯化铁水溶液呈酸性,原因是(用离子方程式表示)_________________________。实验室在临时配制一些氯化铁溶液时,常将氯化铁固体先溶于较浓的__________中,然后再用蒸馏水稀释到所需要的浓度,是为了抑制其水解。
(2)25℃时,浓度为0.1 mol/L的6种溶液:①HCl ②CH3COOH ③Ba(OH)2 ④ Na2CO3 ⑤ KCl ⑥NH4Cl,溶液的pH由小到大的顺序为________(填序号)[已知Kb(NH3·H2O)=1.8×10-5,Ka(CH3COOH)=1.75×10-5]。
(3)电离平衡常数可用来衡量弱电解质的电离程度。已知如下表数据(25℃):
化学式 | HCN | CH3COOH | H2CO3 |
电离平衡常数 | K=4.9×1010 | K=1.8×105 | K1=4.4×107 K2=4.7×1011 |
①25 ℃时,等物质的量浓度的3种溶液:a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液,其pH由大到小的顺序为________________(填序号)。
②25 ℃时,向NaCN溶液中通入少量的CO2,发生反应的离子方程式为_________________。
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中的Cl恰好完全沉淀(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为__________mol·L1,此时溶液中c(CrO42)为_________mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
【答案】Fe3++3H2O![]() Fe(OH)3+3H+ 盐酸 ①<②<⑥<⑤<④<③ 或 ①②⑥⑤④③ b>a>c 或 bac CN+CO2+H2O=HCO3+HCN 2.0×10-5 5×10-3
Fe(OH)3+3H+ 盐酸 ①<②<⑥<⑤<④<③ 或 ①②⑥⑤④③ b>a>c 或 bac CN+CO2+H2O=HCO3+HCN 2.0×10-5 5×10-3
【解析】
(1)氯化铁为强酸弱碱盐,铁离子会发生水解导致其水溶液呈酸性,其水解离子方程式为:Fe3++3H2O![]() Fe(OH)3+3H+;因铁离子溶液发生水解,因此在配制氯化铁溶液时,常先加入浓盐酸中,再稀释成所需要的溶液;
Fe(OH)3+3H+;因铁离子溶液发生水解,因此在配制氯化铁溶液时,常先加入浓盐酸中,再稀释成所需要的溶液;
(2)HCl和CH3COOH为酸,Ba(OH)2为碱,Na2CO3、KCl和NH4Cl为盐,HCl为强酸,CH3COOH为弱酸,相同浓度的盐酸和醋酸,醋酸中氢离子浓度小于盐酸,所以pH 盐酸小于醋酸;
碳酸钠为强碱弱酸盐,其溶液呈碱性,但其水解程度较小,故pH Ba(OH)2大于Na2CO3;
氯化钾为强酸强碱盐,为中性;
氯化铵为强酸弱碱盐,其溶液为酸性,由Kb(NH3·H2O)=1.8×10-5,Ka(CH3COOH)=1.75×10-5可知,![]() ; Ka(CH3COOH)=1.75×10-5> Kh(NH4+),相同浓度的CH3COOH与NH4Cl溶液,醋酸的pH小于NH4Cl的pH;
; Ka(CH3COOH)=1.75×10-5> Kh(NH4+),相同浓度的CH3COOH与NH4Cl溶液,醋酸的pH小于NH4Cl的pH;
则这几种溶液的pH由小到大的顺序是①②⑥⑤④③;
(3)电离常数越大,酸的酸性越强,酸性越强,对应离子的水解能力越弱。根据表中电离常数数据,可得酸性强弱顺序为:CH3COOH>H2CO3>HCN>HCO3-,对应离子的水解能力:CH3COO-<HCO3-<CN-<CO32-;
①因离子的水解能力:CH3COO-<HCO3-<CN-<CO32-,均为阴离子水解,水解能力越大,所得溶液的碱性越强,pH越大。则有25℃时,等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为 Na2CO3>NaCN>CH3COONa,即b>a>c 或 bac;
②因离子的水解能力:HCO3-<CN-<CO32-,可知,CO32-结合H+的能力大于CN-,则可知在NaCN溶液中通入少量CO2,所发生反应的离子方程式为 CN+CO2+H2O=HCO3+HCN;
当溶液中Cl-完全沉淀时,即c(Cl-)=1.0×105 mol·L1,根据溶度积常数Ksp(AgCl)=2.0×1010,可得溶液中c(Ag+)=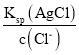 =
=![]() =2.0×10-5 mol·L1;此时刚好生成Ag2CrO4沉淀,则此时溶液中c(CrO42)=
=2.0×10-5 mol·L1;此时刚好生成Ag2CrO4沉淀,则此时溶液中c(CrO42)= 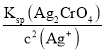 =
= 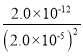 =5×10-3 mol·L1。
=5×10-3 mol·L1。

 阅读快车系列答案
阅读快车系列答案【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
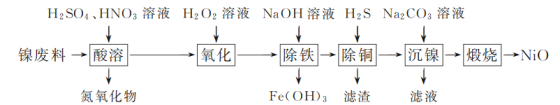
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是________。
(2) “氧化”时,Fe2+参加反应的离子方程式为________。
(3) “除铁”时需控制溶液的pH范围为________。
(4) “滤渣”的主要成分为________(填化学式)。
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是________。