题目内容
【题目】下列有关硫、氮单质及其化合物的叙述正确的是( )
A.SO2、NO2均为酸性氧化物
B.“雷雨肥庄稼”与氮的固定有关
C.硫粉在过量的纯氧中燃烧可以生成SO3
D.亚硫酸钠可长期暴露在空气中,不易变质
【答案】B
【解析】
A.二氧化氮与氢氧化钠反应生成了硝酸钠和亚硝酸钠,发生了氧化还原反应而不是复分解反应,所以不属于酸性氧化物,故A错误;
B.“雷雨肥庄稼”过程发生的主要化学反应有:N2+O2![]() 2NO,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO,HNO3与土壤中的弱酸盐反应生成硝酸盐,农作物吸收硝酸根中化合态的N,第一个反应是“将游离态的氮转化为化合态氮”,与氮的固定有关,故B正确;
2NO,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO,HNO3与土壤中的弱酸盐反应生成硝酸盐,农作物吸收硝酸根中化合态的N,第一个反应是“将游离态的氮转化为化合态氮”,与氮的固定有关,故B正确;
C.硫粉在过量的纯氧中燃烧只能生成SO2,不可能生成SO3,二氧化硫与氧气在一定条件下反应生成二氧化硫,故C错误;
D.亚硫酸盐中硫为+4价,具有强的还原性,容易被空气中的氧气氧化,暴露在空气中易变质,故D错误;
综上所述答案为B。

【题目】我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
Ⅰ.已知:2CO(g) + O2(g)=2CO2(g) ΔH=-566 kJ/mol
2Fe(s) + 3/2O2(g)=Fe2O3(s) ΔH=-825.5 kJ/mol
反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ΔH=________ kJ/mol。
2Fe(s)+3CO2(g) ΔH=________ kJ/mol。
Ⅱ.反应1/3Fe2O3(s)+CO(g)![]() 2/3 Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一容积为10 L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡。
2/3 Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一容积为10 L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡。
(1)CO的平衡转化率为 __________。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是 _________。
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下与H2反应制备甲醇: CO(g)+2H2(g)![]() CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
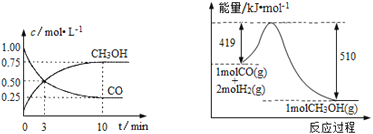
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率υ(H2)=_____________。
(2)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
容器 | 反应物投入的量 | 反应物 转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
甲 | 1 molCO和2 molH2 | α1 | c1 | 放出Q1 kJ热量 |
乙 | 1 molCH3OH | α2 | c2 | 吸收Q2 kJ热量 |
丙 | 2 molCO和4 molH2 | α3 | c3 | 放出Q3 kJ热量 |
则下列关系正确的是 _________(填序号)。
A.c1=c2;B.2Q1=Q3;C.2α1=α3;D.α1+α2=1;E.该反应若生成1 molCH3OH,则放出(Q1+Q2)kJ热量