题目内容
【题目】等量的NaOH分别与![]() 和
和![]() 的醋酸恰好中和,消耗二者的体积依次为
的醋酸恰好中和,消耗二者的体积依次为![]() 和
和![]() ,则
,则![]() 、
、![]() 的关系为( )
的关系为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
【答案】D
【解析】
醋酸为弱电解质,醋酸的浓度越大,电离程度越小,设pH为2和3的醋酸的电离度分别为![]() 、
、![]() ,则
,则![]() ,据此列式计算出醋酸的物质的量浓度,再根据消耗氢氧化钠的物质的量相等,说明两溶液中含有醋酸的物质的量相等,据此列式比较
,据此列式计算出醋酸的物质的量浓度,再根据消耗氢氧化钠的物质的量相等,说明两溶液中含有醋酸的物质的量相等,据此列式比较![]() 和
和![]() 的大小。
的大小。
等量的NaOH分别与pH为2和3的醋酸恰好完全反应,说明两醋酸溶液中含有的溶质的物质的量相等,
设pH为2和3的醋酸的电离度分别为![]() 、
、![]() ,则
,则![]() ,
,
![]() 体积pH为2的醋酸溶液中含有醋酸的物质的量为:
体积pH为2的醋酸溶液中含有醋酸的物质的量为:![]() ,
,
![]() 体积pH为3的醋酸溶液中含有醋酸的物质的量为:n=cV=
体积pH为3的醋酸溶液中含有醋酸的物质的量为:n=cV=![]() ×V2,
×V2,
则![]() ×V1=
×V1=![]() ×V2,整理可得:
×V2,整理可得:![]() ,由于
,由于![]() ,
,![]() ,所以
,所以![]() ,即
,即![]() ,
,
故选D。

 名校课堂系列答案
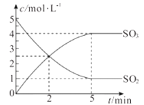
名校课堂系列答案【题目】一定温度下,向2.0L恒容密闭容器中充入2molSO2和1molO2,发生反应为:2SO2(g)+O2(g) ![]() 2SO3(g)。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:下列说法正确的是( )
2SO3(g)。经过一段时间后达到平衡,反应过程中测定的部分数据见下表:下列说法正确的是( )
t/s | 0 | 2 | 4 | 6 | 8 |
n(SO3)/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
A.反应在前2 s的平均速率υ(O2)=0.4 mol·L1·s1
B.保持其他条件不变,体积压缩到1.0 L,平衡常数将增大
C.相同温度下,起始时向容器中充入4 mol SO3,达平衡时,SO3的转化率大于10%
D.保持温度不变,向该容器中再充入2 mol SO2、1 mol O2,反应达到新平衡时n(SO3)/n(O2) 增大
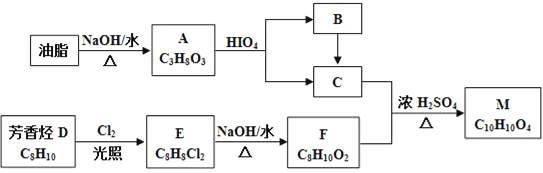
【题目】回答下列问题:
(1)氯化铁水溶液呈酸性,原因是(用离子方程式表示)_________________________。实验室在临时配制一些氯化铁溶液时,常将氯化铁固体先溶于较浓的__________中,然后再用蒸馏水稀释到所需要的浓度,是为了抑制其水解。
(2)25℃时,浓度为0.1 mol/L的6种溶液:①HCl ②CH3COOH ③Ba(OH)2 ④ Na2CO3 ⑤ KCl ⑥NH4Cl,溶液的pH由小到大的顺序为________(填序号)[已知Kb(NH3·H2O)=1.8×10-5,Ka(CH3COOH)=1.75×10-5]。
(3)电离平衡常数可用来衡量弱电解质的电离程度。已知如下表数据(25℃):
化学式 | HCN | CH3COOH | H2CO3 |
电离平衡常数 | K=4.9×1010 | K=1.8×105 | K1=4.4×107 K2=4.7×1011 |
①25 ℃时,等物质的量浓度的3种溶液:a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液,其pH由大到小的顺序为________________(填序号)。
②25 ℃时,向NaCN溶液中通入少量的CO2,发生反应的离子方程式为_________________。
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中的Cl恰好完全沉淀(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为__________mol·L1,此时溶液中c(CrO42)为_________mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。