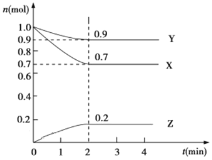
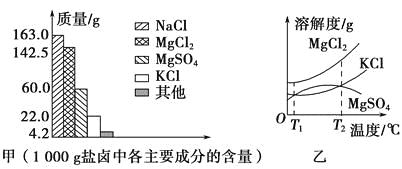
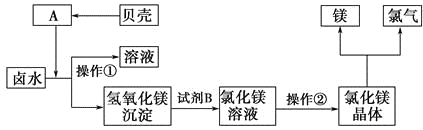
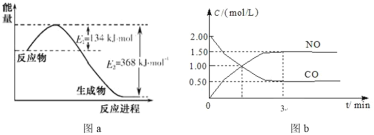
【题目】弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。下列方法中,可以使醋酸溶液中CH3COOH电离程度增大的是_______。
A. 滴加少量浓盐酸 B. 微热溶液 C. 加水稀释 D. 加入少量醋酸钠晶体
(2)用0.1mol·L-1NaOH溶液分别滴定体积均为 20mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液, 得到滴定过程中溶液 pH 随加入 NaOH 溶液体积而变化的两条滴定曲线。
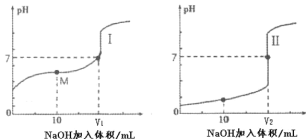
①滴定醋酸的曲线是_______(填“I”或“II”)。
②图I中 V=10 时,溶液中的c(Na+)________c(A-)。(填“>”、“=”或“<”,其中A-代表酸根离子)
(3)下表为某同学所测 25℃时,甲、乙两种溶液的 pH。
甲 | 乙 | |
pH | 11 | 11 |
溶液 | 氨水 | 氢氧化钠溶液 |
①甲溶液中的c(OH-) =_________mol/L。
②25℃时,等体积的甲、乙两溶液与等浓度的盐酸恰好完全反应,消耗的盐酸体积:甲_______乙。(填“>”、“=”或“<”)
③甲、乙溶液均加水稀释 10 倍后,所得溶液的 pH:甲______乙。(填“>”、“=”或“<”)
(4)下表是几种常见弱酸的电离常数
化学式 | CH3COOH | H2SO3 | HClO | H2CO3 |
电离常数 | 1.8×10-5 | K1=1.23×10-2 K2=6.6×10-8 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
以下反应对应的离子方程式正确的是_______。
A.Na2CO3溶液吸收少量SO2:![]() +SO2+H2
+SO2+H2![]() +
+![]()
B.漂白液生效的原理:ClO-+CO2+H2O = HClO+![]()
C.次氯酸钠溶液吸收少量SO2:ClO-+SO2+H2O = HClO+![]()
D.醋酸除水垢中的CaCO3:2CH3COOH+CaCO3= Ca2++2CH3COO-+H2O+CO2↑
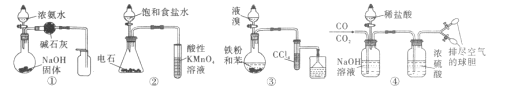
【题目】下列实验中的操作,对应的现象以及结论都正确的是![]()
![]()
选项 | 操作 | 现象 | 结论 |
A | 向 | 产生白色沉淀 |
|
B | 蘸有浓氨水的玻璃捧靠近X | 有白烟产生 | X一定是浓盐酸 |
C | 向澄清石灰水加入某试剂的溶液少许 | 产生白色沉淀 | 该试剂中一定含有 |
D | 炭粉中加入浓硫酸并加热,导出的气体通入 | 有白色沉淀产生 | 有 |
A.AB.BC.CD.D