题目内容
【题目】图 a 是 1 mol NO2 和 1 mol CO 恰好反应生成 CO2 和 NO 过程中的能量变化示意图;现往体积固定的密闭容器中通入等物质的量的 NO2 和 CO,反应中的 CO 和 NO 的浓度随时间变化的示意图如 b 图。根据图意回答下列问题:
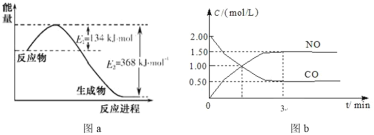
(1)写出 NO2 和CO 反应的热化学方程式__________。
(2)从反应开始到平衡,用 NO2 浓度变化表示平均反应速率 v(NO2)=_________。
(3)此温度下达到平衡时 NO2 的转化率为_________。
(4)830K 时,在密闭容器中发生下列可逆反应CO(g)+H2O(g)CO2(g)+H2(g) △H<0。试回答下列问题:
①若起始时 c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时 CO 的转化率为 60%,则在该温度下,该反应的平衡常数 K=__。
②在相同温度下,若起始时 c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得 H2 的浓度为 0.5mol·L-1,则此时该反应______(填“是”与“否”)达到平衡状态,此时 v(正)_____v(逆)(填“>”、“=”或“<”)。
【答案】NO2 (g) + CO(g) = NO(g) + CO2(g) ΔH =-234 kJ·mol1 ![]() 75% 1 否 >
75% 1 否 >
【解析】
根据焓变等于反应物的活化能-生成物的活化能分析,根据图像求出NO2的改变量,再计算NO2的速率和转化率,通过建立三段式进行计算平衡常数,再计算浓度商来判断是否达到平衡。
(1) NO2 和CO 反应的热化学方程式NO2 (g) + CO(g) = NO(g) + CO2(g) ΔH =134 kJ·mol1-368 kJ·mol1=-234 kJ·mol1;故答案为:NO2 (g) + CO(g) = NO(g) + CO2(g) ΔH =-234 kJ·mol1。
(2)从反应开始到平衡,NO改变量为1.5 molL1,则NO2的改变量为1.5 molL1,用NO2浓度变化表示平均反应速率![]() ;故答案为:
;故答案为:![]() 。
。
(3)由于体积固定的密闭容器中通入等物质的量的 NO 和 CO,CO开始的浓度为2 molL1,平衡时改变量为1.5 molL1,此温度下达到平衡时 NO2的转化率为![]() ;故答案为:75%。
;故答案为:75%。
(4)①若起始时 c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时 CO 的转化率为 60%,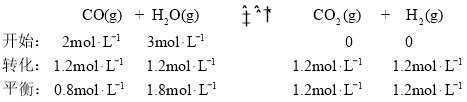 ,则在该温度下,该反应的平衡常数
,则在该温度下,该反应的平衡常数 ![]() ;故答案为:1。
;故答案为:1。
②在相同温度下,若起始时 c(CO)=1 molL1,c(H2O)=2 molL1,反应进行一段时间后,测得 H2 的浓度为 0.5 molL1,则此时c(CO2)=0.5 molL1,c(CO)=(1-0.5) molL1=0.5 molL1,c(H2O)= (2-0.5) molL1=1.5 molL1,则此时浓度商![]() ,因此此时该反应没有达到平衡状态,平衡正向移动,因此υ(正) >υ(逆);故答案为:否;>。
,因此此时该反应没有达到平衡状态,平衡正向移动,因此υ(正) >υ(逆);故答案为:否;>。

【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是()
A | B | C | D |
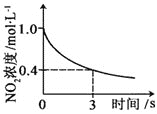
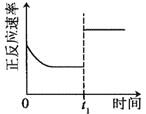
|
|
|
|
升高温度,正反应方向平衡常数减小 | 0~3s内,反应速率为:v(NO2)=0.2 mol·L-1·s-1 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
A. AB. BC. CD. D