题目内容
【题目】弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。下列方法中,可以使醋酸溶液中CH3COOH电离程度增大的是_______。
A. 滴加少量浓盐酸 B. 微热溶液 C. 加水稀释 D. 加入少量醋酸钠晶体
(2)用0.1mol·L-1NaOH溶液分别滴定体积均为 20mL、浓度均为0.1mol·L-1的盐酸和醋酸溶液, 得到滴定过程中溶液 pH 随加入 NaOH 溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是_______(填“I”或“II”)。
②图I中 V=10 时,溶液中的c(Na+)________c(A-)。(填“>”、“=”或“<”,其中A-代表酸根离子)
(3)下表为某同学所测 25℃时,甲、乙两种溶液的 pH。
甲 | 乙 | |
pH | 11 | 11 |
溶液 | 氨水 | 氢氧化钠溶液 |
①甲溶液中的c(OH-) =_________mol/L。
②25℃时,等体积的甲、乙两溶液与等浓度的盐酸恰好完全反应,消耗的盐酸体积:甲_______乙。(填“>”、“=”或“<”)
③甲、乙溶液均加水稀释 10 倍后,所得溶液的 pH:甲______乙。(填“>”、“=”或“<”)
(4)下表是几种常见弱酸的电离常数
化学式 | CH3COOH | H2SO3 | HClO | H2CO3 |
电离常数 | 1.8×10-5 | K1=1.23×10-2 K2=6.6×10-8 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
以下反应对应的离子方程式正确的是_______。
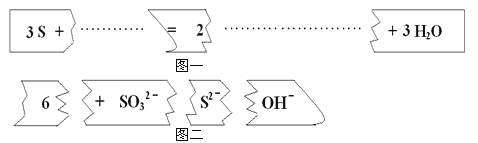
A.Na2CO3溶液吸收少量SO2:![]() +SO2+H2
+SO2+H2![]() +
+![]()
B.漂白液生效的原理:ClO-+CO2+H2O = HClO+![]()
C.次氯酸钠溶液吸收少量SO2:ClO-+SO2+H2O = HClO+![]()
D.醋酸除水垢中的CaCO3:2CH3COOH+CaCO3= Ca2++2CH3COO-+H2O+CO2↑
【答案】BC I < 0.001 > > BD
【解析】
(1)A. 滴加少量浓盐酸,增大了氢离子的浓度,平衡左移,CH3COOH电离程度减小;
B. 微热溶液,促进醋酸电离,CH3COOH电离程度增大;
C. 加水稀释,促进醋酸电离,CH3COOH电离程度增大;
D .加入少量醋酸钠晶体,增大了醋酸根离子浓度,平衡左移,CH3COOH电离程度减小;
(2)①盐酸是强酸、醋酸是弱酸,0.1 mol·L-1的盐酸中c(H+)=0.1mol/L,0.1 mol·L-1醋酸中c(H+)<0.1mol/L,所以盐酸的pH=1,醋酸的pH>1;
②图I中,V=10时,pH<7,所以c(H+)>c(OH-),根据电荷守恒c(H+)+c(Na+)=c(OH-)+c(CH3COO-),故c(Na+)<c(CH3COO-);
(3)①甲溶液的pH =11,c(H+)=10-11ol/L,c(OH-) =10-3mol/L;
②由于氨水是弱碱,c(NH3H2O) >10-3mol/L,c(NaOH) =10-3mol/L;
③由于氨水是弱碱,稀释过程中电离程度增大,n(OH-)增大;NaOH是强碱;
(4)根据表格提供的数据和强酸制弱酸的原理分析可得。
(1)A. 滴加少量浓盐酸,增大了氢离子的浓度,平衡左移,CH3COOH电离程度减小,选项A错误;
B. 微热溶液,促进醋酸电离,CH3COOH电离程度增大,选项B正确;
C. 加水稀释,促进醋酸电离,CH3COOH电离程度增大,选项C正确;
D .加入少量醋酸钠晶体,增大了醋酸根离子浓度,平衡左移,CH3COOH电离程度减小,选项D错误;
答案选BC;
(2)①盐酸是强酸、醋酸是弱酸,0.1mol·L-1的盐酸中c(H+)=0.1mol/L,0.1mol·L-1醋酸中c(H+)<0.1mol/L,所以盐酸的pH=1,醋酸的pH>1,根据图知,I是醋酸曲线,Ⅱ是盐酸曲线,故答案为I;
②图I中,V=10时,pH<7,所以c(H+)>c(OH-),根据电荷守恒c(H+)+c(Na+)=c(OH-)+c(CH3COO-),故c(Na+)<c(CH3COO-),故答案为<;
(3)①甲溶液的pH =11,c(H+)=10-11mol/L,c(OH-) =10-3mol/L,故答案为0.001;
②由于氨水是弱碱,c(NH3H2O) >10-3mol/L,c(NaOH) =10-3mol/L,所以25℃时,等体积的甲、乙两溶液与等浓度的盐酸反应,消耗的盐酸体积:甲>乙,故答案为>;
③由于氨水是弱碱,稀释过程中电离程度增大,n(OH-)增大;NaOH是强碱,故甲、乙溶液均加水稀释10倍后,所得溶液的pH:甲>乙,故答案为>;
(4)A.根据表格提供的数据可知HSO3-的酸性介于H2CO3和HCO3-之间,正确的离子方程式为:SO2+2CO32-+H2O=SO32-+2HCO3-,A错误;
B. 根据表格提供的数据可知HClO的酸性介于H2CO3和HCO3-之间,该离子方程式正确,故B正确;
C. HClO能把SO32-氧化成SO42-,C错误;
D.根据表格提供的数据可知醋酸的酸性大于碳酸,该离子方程式正确,D正确;
答案选BD。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验中的操作,对应的现象以及结论都正确的是![]()
![]()
选项 | 操作 | 现象 | 结论 |
A | 向 | 产生白色沉淀 |
|
B | 蘸有浓氨水的玻璃捧靠近X | 有白烟产生 | X一定是浓盐酸 |
C | 向澄清石灰水加入某试剂的溶液少许 | 产生白色沉淀 | 该试剂中一定含有 |
D | 炭粉中加入浓硫酸并加热,导出的气体通入 | 有白色沉淀产生 | 有 |
A.AB.BC.CD.D
【题目】下列实验的现象、解释或结论正确的是( )
选项 | 实验 | 解释或结论 |
A | 向某溶液中逐渐通入CO2气体,先出现白色胶状沉淀,继续通入CO2气体,白色胶状沉淀不溶解,证明该溶液中存在AlO2- | Al(OH)3是两性氢氧化物,不溶于碳酸溶液 |
B | 在新制氯水中加入碳酸钙粉末,充分搅拌,氯水的漂白性增强 | 氯水中HClO的物质的量浓度增大 |
C | 用蒸馏法能将溶解在CCl4中的碘分离出来 | 因为碘易升华,先分离出来 |
D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,则溶液变为黄色 | 氧化性:H2O2 > Fe3+ |
A.AB.BC.CD.D