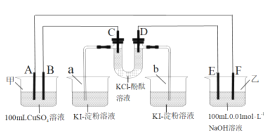
题目内容
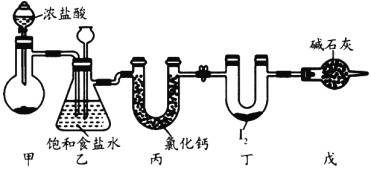
【题目】如图装置中,容器甲内充入0.1 mol NO气体。干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体。恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积9/10,干燥管中物质的质量增加了2.24 g。随着CO2的继续通入,活塞又逐渐向右移动。下列说法中正确的是
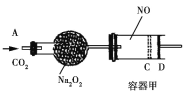
A. 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L(标准状况)
B. NO2转化为N2O4的转化率为20%
C. 容器甲中NO已反应完
D. 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01
【答案】D
【解析】
本题主要考查过氧化钠与二氧化碳反应,NO与氧气反应,2NO2![]() N2O4以及化学平衡的相关计算。CO2通入时,干燥管中发生反应:2Na2O2+2CO2===4NaOH+O2,C中发生反应:2NO+O2===2NO2
N2O4以及化学平衡的相关计算。CO2通入时,干燥管中发生反应:2Na2O2+2CO2===4NaOH+O2,C中发生反应:2NO+O2===2NO2![]() N2O4,导致气体体积减小。
N2O4,导致气体体积减小。
A.根据干燥管中固体物质的质量增加量计算通入的CO2体积;
B.根据O2计算出生成的NO2物质的量,再根据体积变化计算出转化的NO2物质的量,从而计算出转化率;
C.根据O2物质的量计算反应的NO;
D.因继续通入CO2时,体积不会缩小,即干燥管中Na2O2已反应完,活塞向右移动,2NO2![]() N2O4平衡向左移动,由此判断a值。
N2O4平衡向左移动,由此判断a值。
A.设通入标准状况下CO2气体的体积为x,产生氧气的体积为y,则:
2Na2O2+2CO2===2Na2CO3+O2 质量装置△m
2×22.4 L 22.4 L 56 g
x y 2.24 g
所以56 g:2.24g=2×22.4 L:x,解得x=1.792L,56 g:2.24g=22.4 L:y,解得:y=0.896L,即:通入二氧化碳的体积为1.792L,故A错误;
B.由A计算可知,生成氧气的物质的量:n(O2)=![]() =0.04mol,
=0.04mol,
2NO+O2===2NO2
2 1 2
0.08mol 0.04 mol0.08 mol
0.1 mol>0.08 mol,所以NO过量,生成NO2的物质的量为0.08 mol,
2NO2![]() N2O4 物质的量减少△n
N2O4 物质的量减少△n
2 1 1
0.02 mol 0.1 mol×(1-![]() )=0.01mol
)=0.01mol
所以NO2转化为N2O4的转化率为:![]() ×100%=25%,故B错误;
×100%=25%,故B错误;
C.根据B的计算可知,NO还剩余:0.1mol-0.08mol=0.02mol,故C错误;
D.活塞移至C,体积不会再减少,则干燥管中Na2O2已反应完,活塞由C向D移动,体积扩大,2NO2![]() N2O4平衡左移,使二者物质的量增多,活塞移至D时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol,故D正确。
N2O4平衡左移,使二者物质的量增多,活塞移至D时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol,故D正确。