【题目】某学习小组研究NaOH与某些酸之间的反应。
Ⅰ.中和热的测定
在25℃、101kPa条件下,强酸与强碱的稀溶液中和热可表示为:H+(aq)+ OH─(aq)= H2O(l) △H =-57.3kJ·mol1。按照图所示装置进行实验。
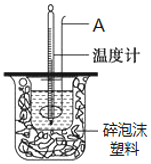
(1)仪器A的名称是______。
(2)碎泡沫塑料的作用是___________。
(3)在25℃、101kPa条件下,取50mL 0.50 mol·L1 CH3COOH溶液、50mL 0.55 mol·L1 NaOH溶液进行实验,测得的中和热△H____-57.3kJ·mol1(填“>”“=”或“<”)。
Ⅱ.中和滴定
(1)用酸式滴定管量取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加1~2滴酚酞作指示剂,用0.20 mol·L—1NaOH标准溶液进行滴定。为了减小实验误差,该同学一共进行了三次实验,假设每次所取稀盐酸体积均为20.00 mL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗NaOH溶液体积/mL | 19.00 | 23.00 | 23.02 |
该盐酸的浓度约为_________(保留两位有效数字)。滴定达到终点的标志是__________。
(2)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______。
A. 滴定终点读数时俯视读数
B. 酸式滴定管使用前,水洗后未用待测盐酸润洗
C. 锥形瓶水洗后未干燥
D. 配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中
E. 配制NaOH标准溶液时,定容时仰视容量瓶的刻度线
F. 碱式滴定管尖嘴部分有气泡,滴定后消失