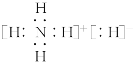题目内容
【题目】(1)某浓度的氨水中存在下列平衡:NH3H2O![]() NH4++OH-,若想增大NH4+的浓度,而不增加OH-的浓度,应采取的措施是__。(填序号)
NH4++OH-,若想增大NH4+的浓度,而不增加OH-的浓度,应采取的措施是__。(填序号)
①适当升高温度②加入NH4Cl固体③通入NH3④通入少量HCl气体
(2)常温下,有pH相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,产生等量的氢气时,所需要的时间:醋酸_____盐酸(填“>”、“=”或“<”)。
(3)已知电离平衡常数,H2SO3:K1 = 1.54×10-2,K2 = 1.02×10-7;H2CO3:K1 = 4.3×10-7,K2 = 5.6×10-11; CH3COOH:Ka=1.8×105。
① HSO3-的电离平衡常数表达式为:______。
② H2SO3溶液与NaHCO3溶液反应的主要离子方程式为_________。
③在25℃的条件下,向0.1mol·L1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO)=5∶9,此时溶液pH=___。
【答案】②④ < K2=![]() H2SO3 + HCO3- = HSO3- + CO2↑+ H2O 5
H2SO3 + HCO3- = HSO3- + CO2↑+ H2O 5
【解析】
(1)①适当升高温度,平衡正向移动,c(NH4+)增大,c(OH-)增大,故错误;
②加入氯化铵固体,c(NH4+)增大,平衡逆向移动,c(OH-)减小,故正确;
③向氨水中通入氨气,c(NH4+)增大,c(OH-)增大,故错误;
④通入少量HCl气体,HCl电离产生的H+消耗OH-,平衡逆向移动,c(NH4+)增大,c(OH-)减小,故正确;
答案选②④;
(2)常温下,pH相等的醋酸和盐酸,醋酸浓度大于盐酸,所以pH、体积相等的醋酸和盐酸,醋酸的物质的量大于盐酸,则分别与足量的锌反应醋酸放出的氢气多,且醋酸产生氢气的速率更快,产生等量的氢气时,所需要的时间:醋酸<盐酸;
(3)①根据电离方程式HSO3-![]() H+ + SO32-可知,HSO3-的电离平衡常数表达式为:K2=
H+ + SO32-可知,HSO3-的电离平衡常数表达式为:K2=![]() ;
;
②根据H2SO3:K1 = 1.54×10-2,K2 = 1.02×10-7;H2CO3:K1 = 4.3×10-7,K2 = 5.6×10-11;可知酸性:H2SO3> H2CO3> HSO3-,H2SO3溶液与NaHCO3溶液反应的主要离子方程式为H2SO3 + HCO3- = HSO3- + CO2↑+ H2O;
③在25℃的条件下,向0.1mol·L1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO)=5∶9,此时溶液中Ka=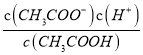 =
=![]() ×
×![]() =1.8×105,故
=1.8×105,故![]() =1.0×105mol/L,pH=5。
=1.0×105mol/L,pH=5。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
完成下列填空:
(1)硫原子的核外电子排布式为__,硫原子的核外电子占有__个轨道,Z元素在元素周期表中的位置为__,Y原子核外有______种能量不同的电子。
(2)H2S分子中H-S键键角为92°,说明H2S分子是__(填“极性”“非极性”)分子。
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是__。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫单质得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成0.1molX的最高价化合物,恢复至室温,放热68.7kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式___。
(5)碳酸钠溶液中滴入酚酞,溶液显红色,请用离子方程式解释产生该现象的原因:___;在上述红色的溶液中加入少许氯化钙固体,溶液颜色变浅,请用平衡理论解释产生该现象的原因___。