题目内容
【题目】物质结构决定性质,新材料的不断涌现有力地促进了社会进步,因此了解物质结构具有重要意义。试回答下列问题:
(1)基态铁原子中未成对电子数为_________,在水溶液中常以Fe2+、Fe3+的形式存在,其中________更稳定。
(2)OF2中氧元素的化合价为____,中心原子的杂化方式为___,OF2的分子极性比H2O的__________(选填“大”或“小”)。
(3)一种新型铝离子电池中的电解质溶液由某种有机阳离子与AlCl4﹣、Al2Cl7﹣构成,AlCl4﹣的立体构型为_________,Al2Cl7﹣中的原子都是8电子结构,则Al2Cl7﹣的结构式为(配位键用“→”表示)__________。
(4)FeO晶体与NaCl晶体结构相似,要比较FeO与NaCl的晶格能大小,还需要知道的数据是___________;
(5)氮化铝、氮化硼、氮化镓晶体的结构与金刚石相似,它们晶体的熔点由高到低的顺序是___________。
(6)NH3分子中∠HNH键角为106.7,而配离子[Zn(NH3)6]2+中∠HNH键角为109.5, 配离子[Zn(NH3)6]2+中∠HNH键角变大的原因是_____。
(7)下图是Fe3O4晶体的晶胞。

①晶胞中亚铁离子处于氧离子围成的______(选填“正方形”、“正四面体”或“正八面体”)空隙。
②晶胞中氧离子的堆积方式的名称为________。
③若晶胞的体对角线长为 a nm,则 Fe3O4 晶体的密度为________g/cm3(阿伏加德罗常数用 NA 表示)。
【答案】 4 Fe3+ +2 sp3 小 正四面体 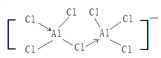 离子半径大小 氮化硼>氮化铝>氮化镓 NH3分子中N原子的孤电子对进入Zn2+的空轨道形成配离子后,原孤电子对与N-H键的成键电子对间的排斥作用变为成键电子对之间的排斥,排斥作用减弱 正四面体 面心立方最密堆积
离子半径大小 氮化硼>氮化铝>氮化镓 NH3分子中N原子的孤电子对进入Zn2+的空轨道形成配离子后,原孤电子对与N-H键的成键电子对间的排斥作用变为成键电子对之间的排斥,排斥作用减弱 正四面体 面心立方最密堆积 ![]()
【解析】试题分析:(1)根据电子排布式或轨道表示式进行判断。(2)根据元素的非金属性和电负性以及价层电子对互斥理论进行判断。(3)根据价层电子对互斥理论进行判断。(4)影响晶格能的因素有配位数、离子半径和离子电荷。(5)原子半径越小,原子晶体中共价键的键长越短,则共价键越强,晶体的熔点越高。(6)根据价层电子对互斥理论进行解释。(7)根据配位数判断堆积方式,根据晶胞的质量和体积求晶体的密度。
(1)基态铁原子的电子排布式为[Ar]3d64s2,根据洪特规则和泡利不相容原理,3d轨道的6个电子要占据其全部5个轨道,故其中未成对电子数为4。铁在水溶液中常以Fe2+、Fe3+的形式存在,其中基态Fe3+电子排布式为[Ar]3d5,其3d轨道为较稳定的半充满状态,故其更稳定。
(2)F是非金属性最强的元素,其最外层有7个电子,故OF2中氧元素的化合价为+2,中心原子O的价层电子对数是4,故其杂化方式为sp3。OF2和H2O的分子空间构型相似,O与F之间的电负性的差值小于H和O的电负性差值,故OF2的分子极性比H2O的小。
(3)AlCl4﹣的中心原子的价层电子对数为4,故其立体构型为正四面体,Al2Cl7﹣中的原子都是8电子结构,则可知Al2Cl7﹣的Al原子各形成了一个配位键,其结构式为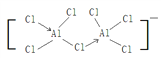 。
。
(4)FeO晶体与NaCl晶体结构相似,影响晶格能大小的因素有配位数、离子半径和离子电荷,故要比较FeO与NaCl的晶格能大小,还需要知道的数据是离子半径大小;
(5)氮化铝、氮化硼、氮化镓晶体的结构与金刚石相似,都是原子晶体,它们晶体的熔点由其共价键的键长决定,键长越短则共价键越强,其熔点越高,因为B、Al、Ga的原子半径依次增大,故熔点由高到低的顺序是氮化硼>氮化铝>氮化镓。
(6)NH3分子中∠HNH键角为106.7,而配离子[Zn(NH3)6]2+中∠HNH键角为109.5, 由价层电子对互斥理论可知,配离子[Zn(NH3)6]2+中∠HNH键角变大的原因是:NH3分子中N原子的孤电子对进入Zn2+的空轨道形成配离子后,原孤电子对与N-H键的成键电子对间的排斥作用变为成键电子对之间的排斥,排斥作用减弱。
(7)①由Fe3O4晶体的晶胞结构示意图可知,晶胞中亚铁离子处于氧离子围成的正四面体空隙。
②晶胞中与每氧离子最近且等距的氧离子有12个,故其堆积方式为面心立方最密堆积。
③根据均摊法,由Fe3O4晶体的晶胞结构示意图可以求出该晶胞中氧离子、铁离子和亚铁离子分别有4、2、1个,故每个晶胞中只有一个Fe3O4。晶胞的体对角线长为 a nm,则晶胞的边长为![]() ,故NA个晶胞的质量和体积分别是232g和
,故NA个晶胞的质量和体积分别是232g和![]() ,则 Fe3O4 晶体的密度为
,则 Fe3O4 晶体的密度为![]() g/cm3。
g/cm3。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案



